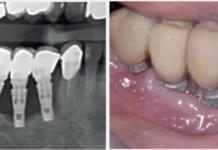
La vite di guarigione in titanio di uno degli 80 casi analizzati.
MATERIALI E METODI
Il posizionamento degli impianti è stato eseguito con un unico protocollo generale secondo tecnica flap-less per limitare variabili di contaminazione batterica del sito chirurgico. L’apertura della mucosa aderente nei siti edentuli è avvenuta mediante l’uso di mucotomo (bisturi circolare) del diametro di 4,1 mm, utilizzato per creare un’incisione completa del lembo della mucosa. È stata posizionata per tutti gli 80 impianti la medesima vite di guarigione con diametro di 5 mm ed altezza di 4 mm.
Ogni sito implantare è stato seguito a partire dal primo mese successivo al posizionamento dell’ impianto, per quattro mesi, corrispondenti al periodo della cosiddetta osteointegrazione, in totale condizione di passività funzionale e biomeccanica.
È stato eseguito, con cadenza mensile, il prelievo della placca batterica accumulata sul campione di 80 impianti per un totale di 640 prelievi nelle due sedi stabilite come oggetto di studio:
lungo il tragitto transmucoso della vite di guarigione;
più in profondità: in corrispondenza dell’interfaccia tra profilo del colletto implantare ed il margine crestale osseo-alveolare.
Per ogni prelievo è stata eseguita l’analisi in termini di profilo batterico, in vivo, secondo morfologia, mediante una tecnica ormai collaudata da oltre vent’anni da parte del nostro gruppo di studio, seguendo i concetti di Listgarten secondo cui un profilo batterico composto prevalentemente da cocchi (70%) è da ritenersi fisiologico e saprofitico a differenza di una prevalente percentuale delle altre morfologie batteriche (bastoncelli, filamentosi e spiraliformi) dal carattere invece patologico (10, 11).
I campioni sono stati siglati come segue:
TTM: campione prelevato dal tragitto transmucoso;
IMC: campione prelevato dall’interfaccia del margine crestale.
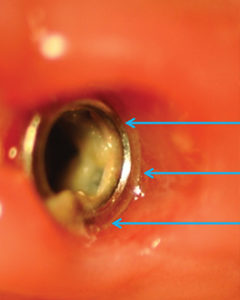
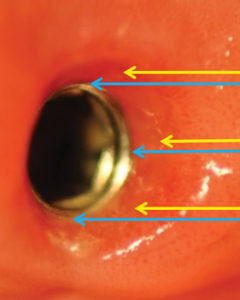
La prima fase di prelievo è stata eseguita mediante puntale sterile nell’ambito del tragitto transmucoso (TTM), mantenendo la vite di guarigione in situ con la presenza del suo film batterico (placca) per non variare le condizioni microbiotiche tra i vari livelli della nicchia di prelievo (fig. 2).
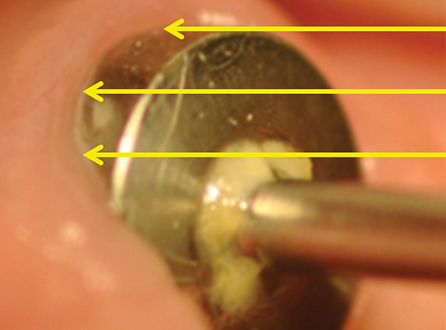
La prima fase di prelievo è stata eseguita mediante puntale sterile nell’ambito del tragitto transmucoso (TTM), indicato dalle frecce, mantenendo la vite di guarigione in situ con la presenza del suo film batterico (placca) per non variare le condizioni microbiotiche tra i vari livelli della nicchia di prelievo.
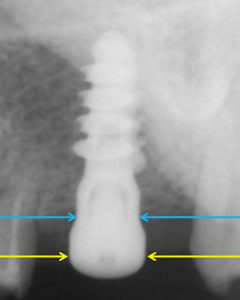
La seconda fase di prelievo (IMC) è stata eseguita dopo rimozione della vite di guarigione con l’accortezza di evitare la contaminazione dello strumento sterile di prelievo lungo il tragitto transmucoso ricco di placca (figg. 3, 4, 5). La vite di guarigione è stata poi riposizionata per mantenere le medesime condizioni ambientali nei tre successivi prelievi a cadenza mensile.
Le viti di guarigione rimosse hanno costantemente evidenziato su tutta la loro superficie una notevole componente di placca batterica (fig. 6).

La placca adesa alla superficie di titanio della vite di guarigione.
Massiccio è stato il riscontro di placca anche all’interno della fixture, nonostante la presenza della vite di guarigione (fig. 3).
La metodica del conteggio morfologico batterico si è svolta mediante microscopia a contrasto di fase su campione in vivo (fig. 7).
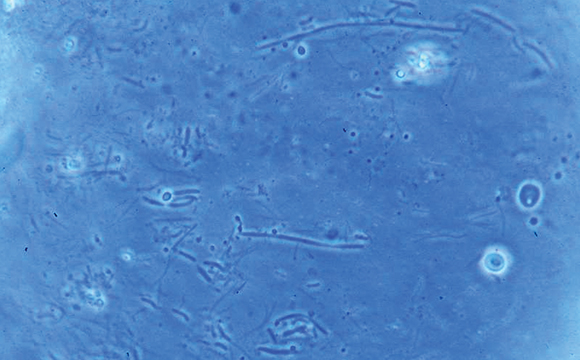
Il materiale prelevato dai siti da analizzare (TTM e IMC), mediante puntale sterile, è stato diluito in soluzione fisiologica all’1% di gelatina liofilizzata.
Con una micropipetta a volume variabile, si sono prelevati dal contenitore 1.000 microlitri di soluzione, disciolti nella provetta madre (PM).
La PM è stata dinamizzata mediante agitatore (mod. AMR 2T), in modo da rendere omogenea la distribuzione del campione nella provetta stessa. Si è lasciato riposare il preparato per tre minuti.
Con la micropipetta dotata di nuovo puntale sterile si sono prelevati 100 microlitri di campione disciolto poi trasferiti in una provetta figlia (PF) contenente 900 microlitri di soluzione fisiologica. In questo modo si è ottenuta una diluizione di 1:10. Questa provetta è stata dinamizzata analogamente alla PM in modo da rendere omogenea la dispersione del contenuto batterico e si è lasciata riposare per tre minuti.
Si sono prelevati poi 100 microlitri di campione diluito e si sono depositati sulla superficie della camera di Burker, coprendo il campione mediante vetrino coprioggetto.
Posizionato il vetrino sullo stativo del microscopio a contrasto di fase, è stata eseguita la lettura mediante obiettivo 40x, effettuata su ogni unità di superficie (1/25 mmq) procedendo convenzionalmente dall’alto verso il basso e da sinistra verso destra, diagonalmente. Sono stati inclusi nel conteggio anche i batteri presenti sui lati contigui basso-destro del reticolo.
I conteggi delle morfologie batteriche sono stati riportati su apposita tabella.
RISULTATI
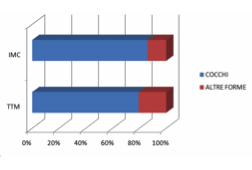
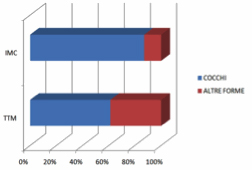
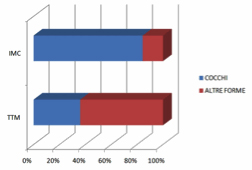
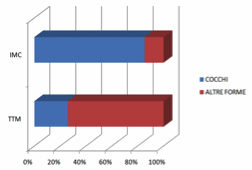
I risultati sono riassunti nella tabella 1.
Dai dati rilevati si evince una significativa differenziazione evolutiva in termini di percentuale di cocchi nei prelievi osservati dai siti TTM rispetto ai siti IMC, lungo il periodo di monitoraggio dei quattro mesi.
La riduzione progressiva dei cocchi a livello del TTM a favore delle altre morfologie batteriche indica una facile colonizzazione della nicchia microbiotica da parte della placca batterica. Il rilievo microbico a livello di IMC rivela che la presenza di cocchi rimane praticamente costante e nettamente prevalente rispetto alle altre morfologie batteriche, a significare condizioni eco-microbiotiche globalmente non favorevoli allo stabilizzarsi di un profilo ricco di bastoncelli, filamentosi e spiraliformi.
Analisi statistica
Trattandosi di valori percentuali, l’analisi statistica è stata condotta con metodi non parametrici (12, 13). Per valutare la significatività statistica delle differenze riscontrate tra i due prelievi contemporanei (TTM e IMC) è stato impiegato il test U di Mann-Whitney (14) (figg. 8-11).
Nei quattro tempi considerati, si è osservata, nei prelievi TTM, una riduzione dei cocchi estremamente significativa rispetto ai prelievi IMC.
Per valutare la significatività statistica delle variazioni riscontrate nel tempo, in ognuno dei due singoli livelli è stato utilizzato il test di Kruskal-Wallis (15):
test di Kruskal-Wallis per TTM:
p < 0.001 = altissima significatività;
test di Kruskal-Wallis per IMC:
p > 0.5 = non significativo.
Ciò significa che la riduzione progressiva dei cocchi a livello di tragitto transmucoso risulta estremamente significativa, mentre a livello di interfaccia del margine crestale non sono avvenute variazioni importanti ed il profilo batterico rimane tendenzialmente costante e non significativo in termini patogenetici (11).
DISCUSSIONE
La ricerca vuole evidenziare come nel cercine mucoimplantare a livello del margine crestale, in assenza del carico occlusale ed in particolare di fattori di pressione ambientale stressogeni (carico occlusale disfunzionale), permanga una spontanea stabilizzazione batterica molto regolare (16, 17, 18). La presenza ordinata e relativamente ripetitiva di cocchi Gram+ ostacola lo sviluppo di condizioni microbiotiche perimplantari patogene atte a favorire condizioni di invasione batterica dei tessuti profondi: infezione e quindi perimplantite (19, 20, 21).
I rapporti di ecosistema, tra organismo ospite e fronte batterico, in termini di componente ecologica integrata, vengono così mantenuti (Microbioma) (22, 23).
L’assenza di sollecitazioni di natura biomeccanica (carico occluso-statico-dinamico) permette il mantenimento di un equilibrio tra il sistema vite implantare-osso-mucosa da una parte e il fronte batterico dall’altra.
La componente batterica mantiene costante valenza saprofitico-commensale, non invasivo-aggressiva, indipendentemente dalle morfologie che progressivamente si sviluppano lungo il tragitto transmucoso (TTM) e l’interfaccia tra impianto e margine crestale osseo (IMC).
CONCLUSIONI
Questo studio è servito a dimostrare che la sola pur massiccia presenza di batteri in un contesto biologico multifattoriale, in assenza di carico, non risulta sufficiente a produrre effetti destabilizzanti sull’equilibrio tra ospite e fronte batterico (24-30).
Il carico disfunzionale (trauma occlusale)potrebbe risultare quale fattore predisponente alla trasformazione del profilo batterico da saprofitico a patogeno (16, 17). ●
federico.meynardi@istitutomagnus.it
- Listgarten MA. The structure of dental plaque. Parodontology 2000 1994;5:652-75.
- Lindhe J, Nyman S. Textbook of clinical periodontology. Coopenhagen: Munksgaard (second edition); 1989.
- Meynardi F, Pasqualini ME, Rossi F, Biancotti P. Confronto del profilo batterico presente in siti implantari con mesostruttura solidarizzata mediante barra saldata e con perno moncone singolo. Doctor Os 2013;24(5):411-5.
- Fanali S. Perrotti V, Riccardi L, Piattelli A, Piccirilli M, Ricci L, Artese L. Inflammatory infiltrate, microvessel density, Vascular Endothelial Growth Factor (VEGF), Nitric Oxide Synthase (NOS), and proliferative activity in soft tissues below intraorally welded titanium bars. J Periodontol 2010 May;81(5):748-57.
- Listgarten MA. The role of dental plaque in gingivitis and periodontitis. J Periodontol 1988;15:485.
- Gandolfo S, Meynardi F, Corrente G, Nelken A. Analisi microbiologica a fresco della placca dento-gengivale. RIS 1994; maggio: 275-86.
- Berglundh T, Lindhe J, Ericsson I, Marinello CP, Liljenberg B. Soft tissue reactions to the de novo plaque formation implants’s and teeth. An experimental study in the dog. Clinical Oral Implants Research 1992;3:1-8.
- Ericsson I, Berglundh T, Marinello CP, Liljenberg B, Lindhe J. Longstanding plaque and gingivitis at implants and teeth in the dog. Clin Oral Implants Research 1992;3:99-103.
- Mombelli A. Prevention and therapy of peri-implant infections. In: Lang NP, Karring T, Lindhe J. Proceedings of the 3rd European Workshop on Periodontology. Berlin: Quintessence; 1999. p. 281-303.
- Meynardi F, Pasqualini M, Biancotti PP. Analisi batteriologica nel follow up in parodontologia. Doctor Os 2011;22(2):120-7.
- Listgarten MA. Structure of the microbial flora associated with periodontal health and disease in man. J Periodontol 1976;1:47-53.
- Peat J, Barton B. Medical statistics: a guide to data analysis and critical apptaisal. London: Blackwell Publishing; 2005.
- Hollander M, Wolfe DA, Chikchen E. Nonparametrical Statistical Methods. New York: John Wiley & Sons. 3rd Ed; 2013.
- Mann AB, Whitney DR. On a test whether one of two random variables is stochastically larger than the other. Annals of Mathematical Statistics 1947;18:50-60.
- Kruskal W, Wallis WA. Use of ranks in one criterion variance analysis. Journal of the American Statistical Association 1952;47:583-621.
- Pasqualini U. Le Patologie Occlusali. Eziopatogenesi e terapia. Milano: Masson; 1993. p. 3-23, 176-92.
- Meynardi F, Rossi F, Grivet Brancot L, Pasqualini ME. Non solo batteri ma un trauma occlusale all’origine della malattia parodontale. Dental Tribune Jan 2013;9(1):19-20.
- Meynardi F, Rossi F, Battaglio C, Biancotti PP, Pasqualini ME. Correlazione evolutiva tra profilo batterico parodontale-perimplantare e carico occlusale disfunzionale. Doctor Os 2011 Apr;22(4):341-5.
- Vettore MV et al. The relationship of stress and anxiety with cronic periodontitis. J Periodontol 2003;30:394-402.
- Genco RJ, Grossi SG. Relationship of stress, distress and inadequate coping behaviors to periodontal disease. J Periodontol 1999;70:711-23.
- Wimmer G, Janda M et al. Coping with stress: its influence on periodontal disease. J of Periodontol 2002;73:1343-51.
- Blaser MJ. Who Are We? Indigenous Microbes and the Ecology of Human Diseases. EMBO Reports 2006;7(10):956-60.
- Lee YK, Mazmanian SK. Has the Microbiota Played a Critical Role in the Evolution of the Adaptive Immune System? Science 2010;330(Dic):1768-73.
- Margulis L, Dorion S. Microcosmos. University of California; Press Berkeley; 1997.
- Meynardi F, Biancotti PP et al. Correlazioni etiopatogenetiche tra parodontopatia e trauma occlusale. IAPNOR - International Academy of Posture and Neuro-Muscolar Occlusion Research 2009;13(1): 3.
- Greenteing G, Lamter I. Cambiamenti dei modelli parodontali: implicazioni terapeutiche. Int J of Period and Res Dent 2003 Mar;4:18-24.
- Kawai T et al. A novel approach in adult periodontitis: an immunodominant of Porphyromonas gingivalis. Clin Diagn Lab Immunol 1998 Jan;5:11-7.
- Wimmer G, Janda M et al. Coping with stress: its influence on periodontal disease. J Periodontol 2002;73:1343-51.
- Van Dike T, Serhan C. Resolution of inflammation: a new paradigm for the pathogenesis of periodontal disease. J Dent Res 2003 Feb;2:82-90.
- Page R, Schroeder H. Current status of the host response in chronic marginal periodontitis. J Periodontol 1981;52:477-91.