Poiché gli impianti dentali sono ormai ampiamente accettati come trattamento riabilitativo e sono diventati una terapia molto diffusa per la riabilitazione dei pazienti, la perimplantite, cioè l’infezione del tessuto osseo perimplantare, rappresenterà una patologia di osservazione sempre maggiore (1-7). È quindi evidente che il trattamento delle malattie perimplantari costituirà una parte sempre più rilevante della futura pratica odontoiatrica.
Proprio per questo trovare un trattamento efficace che garantisca la salute dei tessuti perimplantari duri e molli è fondamentale per prolungare la durata della protesi implanto-portata all’interno del cavo orale (17-25). I protocolli parodontali laser-assistiti, utilizzati per migliorare i risultati dei trattamenti parodontali convenzionali, chirurgici e non, possono essere adattati alle perimplantiti (8-16). Scopo di questo articolo è descrivere le basi scientifiche e le applicazioni cliniche delle tecniche laser-assisted per la cura di parodontiti e perimplantiti.
Il trattamento parodontale laser assistito mediante terapia fotodinamica senza colorante
Il laser è luce e si caratterizza per la sua specifica lunghezza d’onda. Il laser (light amplification by stimulated emission of radiation) è un dispositivo elettromedicale che, previa l’immissione di energia, determina l’emissione da parte di elementi chimici specifici, di una radiazione elettromagnetica, luce appunto, ad alta intensità, con caratteristiche di monocromaticità, coerenza, unidirezionalità.
I laser utilizzati in odontoiatria sono molteplici e si differenziano tra loro principalmente per il mezzo attivo che li alimenta (erbio, CO2, diodi, ecc).
Ogni mezzo attivo (fonte) emette una propria energia radiante di tipo ondulatorio con una propria lunghezza d’onda. Le varie lunghezze d’onda hanno affinità differenti coi vari elementi dell’organismo. La maggior parte dei laser medicali si situano nel campo dell’invisibile. Al di sotto dei 375 nm si ha il campo dei raggi UV, al di sopra dei 775 si hanno i raggi infrarossi. Sia gli ultravioletti sia gli infrarossi sono invisibili in quanto l’occhio umano percepisce la luce tra 375 a 775 nm.
Il laser a seconda del bersaglio e della lunghezza d’onda avrà effetti diversi.
Laser Er:YAG e laser CO2 sono molto assorbiti dall’acqua e dall’idrossiapatite e quindi dai tessuti bersaglio (tessuti molli e duri), di conseguenza la penetrazione nei tessuti sarà molto ridotta (2 micron per il laser Er:YAG, 20 micron per il laser CO2), pertanto non causeranno alcun effetto in profondità. Al contrario laser a diodi e Nd:YAG penetrano molto in profondità quindi oltre ad avere un effetto visibile in superficie possono anche avere effetti non visibili in profondità.
È proprio su questi effetti che si basa la terapia laser in parodontologia.
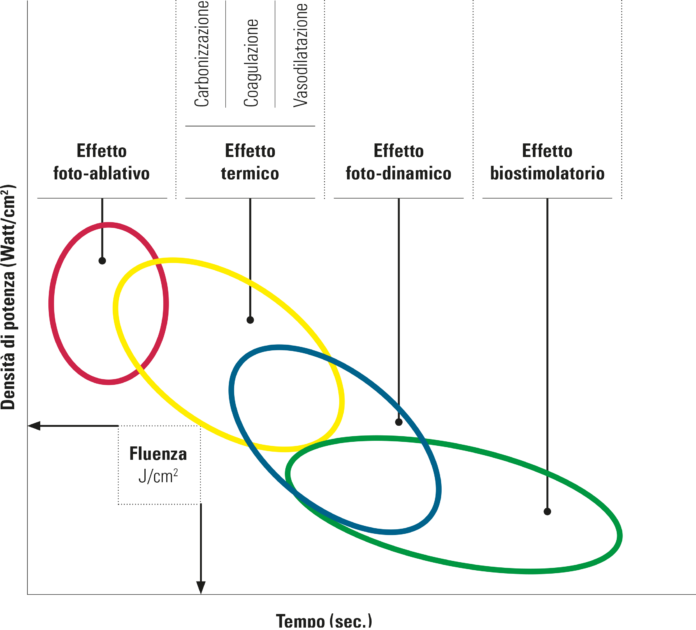
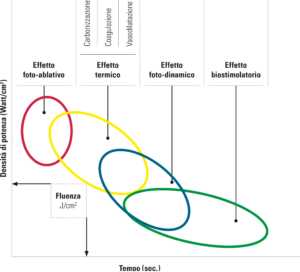
Sulla base del concetto che il laser trasforma l’energia luminosa in energia termica, appare evidente come gli effetti dei laser sui tessuti siano dovuti all’incremento di temperatura degli stessi a causa della cessione di energia termica da parte delle sorgenti laser. Proprio in ragione di importanti e localizzati incrementi di temperatura è possibile ottenere, con i laser, il primo effetto ed il più evidente, in quanto visibile: l’ablazione dei tessuti. In effetti la volatilizzazione dei tessuti avviene quando la temperatura supera i 100 gradi centigradi. Se la temperatura localizzata aumenta in modo importante si potranno avere effetti di denaturazione proteica con dissoluzione del collagene (tra i 50 e i 75 gradi centigradi). Ciò determina effetti di coagulazione, comunque di denaturazione irreversibile dei tessuti.
Se, viceversa, si riesce a mantenere l’incremento della temperatura localizzata al di sotto dei 50 gradi, si avrà solo una leggera vasodilatazione, senza modificazioni irreversibili dei tessuti interessati dall’effetto laser (figura 1).

Importanti sono le differenze degli effetti sulla superficie bersaglio di laser assorbiti (erbio, Co2) e penetranti (diodi, Nd:Yag, helio-neon):
- entrambi i tipi di laser hanno effetti fotoablativi
- i laser assorbiti non vanno in profondità, hanno effetti termici ma non hanno grandi effetti fotodinamici. Sono ideali per le loro capacità ablative, sui tessuti duri (Er:Yag) e sui tessuti molli (CO2 ed Er:Yag)
- i laser penetranti hanno effetti ablativi, termici (forti, medi, deboli), fotodinamici (o decontaminanti) e effetti biostimolanti
- più ci addentriamo nel tessuto più aumentano gli effetti biostimolanti e si riducono quelli decontaminanti.
Se c’è un’infezione batterica dobbiamo eliminare l’infezione, quindi decontaminare. Se l’infezione batterica ha determinato una perdita di sostanza, l’obiettivo è rigenerare la perdita di sostanza grazie alla biostimolazione laser, che determina una sorta di “doping biologico” per i tessuti del paziente, favorendone la rigenerazione. L’effetto fotochimico (o terapia fotodinamica) consiste nell’attivazione di un tessuto iper-ossigenato con un raggio monocromatico; l’interazione tra i tessuti ossigenati e il raggio laser produce reazioni fotochimiche in cui l’accettore di energia è l’ossigeno.
Quindi la sostanza fotosensibilizzante deve sempre contenere ossigeno poiché la presenza di ossigeno permette le reazioni di fotoattivazione e produzione di ossigeno singoletto. L’ossigeno singoletto è un radicale libero dell’ossigeno (un radicale libero è una specie chimica altamente reattiva che possiede elettroni spaiati nello strato esterno); i radicali liberi dell’ossigeno vengono prodotti anche nel nostro organismo.
I neutrofili stimolati dagli anticorpi liberano ossigeno singoletto che attraverso vari meccanismi vanno a distruggere le cellule batteriche (distruzione della membrana plasmatica, degradazione della membrana lisosomiale, alterazione delle funzioni mitocondriali, denaturazione delle molecole di DNA); tuttavia, se i batteri sono troppi o troppo aggressivi, l’organismo non riesce a circoscrivere l’aggressione e diventa necessaria la somministrazione di antibiotici per via sistemica.
La ricerca in parodontologia ha messo a punto protocolli che da un lato usano laser parodontali a basso indice energetico, con lo scopo di non surriscaldare i tessuti parodontali, dall’altro usano coloranti (ad esempio il cloruro di fenotiazina, caratteristico del sistema Helbo), che sono in grado, iniettati nella tasca, di colorare i batteri ivi presenti. L’energia laser, assorbita dal colorante per il quale era affine, determina la liberazione di radicali liberi ed ossigeno singoletto, in grado di denaturare la membrana cellulare e portare alla morte i batteri, senza danneggiare i tessuti dell’ospite.
Tuttavia la letteratura è concorde nel ritenere che non esiste differenza statisticamente significativa in termini di eradicazione dei batteri patogeni tra un protocollo non chirurgico convenzionale e un protocollo non chirurgico convenzionale seguito da terapia fotodinamica con laser di bassa potenza e coloranti.
Da studi in vitro e in vivo si è dimostrato che l’azione decontaminante è adeguata solo se il laser penetrante (diodo) è settato a valori sopra i 2 watt (energia necessaria per poter penetrare in profondità, superando tutti i fenomeni di riflessione, rifrazione e trasmissione che riducano la capacità di assorbimento del raggio nei tessuti) e se veicolata da un liquido, definito fotosensibilizzatore, preferibilmente trasparente e ad alto potere ossigenante, così da non ridurre la profondità di penetrazione del raggio laser nei tessuti. Tale sostanza è stata identificata nel perossido di idrogeno (acqua ossigenata H2O2, 10 volumi 3%, non tossica per i tessuti).
Il tessuto parodontale, sia molle sia duro, preventivamente iperossigenato da irrigazioni di perossido di idrogeno, dopo l’attesa di almeno due minuti, una volta stimolato dalla luce laser, libera dapprima ossigeno fondamentale e poi, per il passaggio di un elettrone all’orbitale superiore, ossigeno singoletto, molecola altamente instabile e dalla emivita brevissima (nell’ordine di 0,0045 microsecondi) in grado di legare gli acidi grassi della membrana batterica e di dissolvere quest’ultima, provocando la batteriolisi.
Come già accennato è necessaria una potenza di cresta superiore ai 2 watt per poter distruggere i complessi batterici rosso e arancione di Socransky, cioè per poter adeguatamente penetrare in profondità. Se però il laser a diodi emettesse costantemente tali livelli di potenza si determinerebbe un surriscaldamento termico eccessivo che porterebbe, da un’iniziale effetto di vasodilatazione (45° C), a una denaturazione delle molecole fino alla carbonizzazione dei tessuti, trasformazioni dovute al progressivo aumento della temperatura tissutale (figura 2).
Per ovviare a questo problema si è introdotta la possibilità di interrompere la fuoriuscita degli impulsi laser con un software che regola gli intervalli di emissione (Ton) con tempi di raffreddamento dei tessuti (Toff).
Per poter rimanere sotto la soglia prefissata di 45° il software deve lavorare in microsecondi (e quindi con alte frequenze, fino ai 10.000 Hz). Ciò permette di lavorare con alte potenze di cresta, fino a 3,5 watt ma senza superare la soglia di potenza media di 0,8 W. Inoltre frequenze elevate, fino a 10.000 Hz, permettono di avere fino a 10.000 volte al secondo liberazione di molecole di ossigeno singoletto all’interno dei tessuti parodontali.
I test di Rey e Caccianiga (8-16) hanno dimostrato che l’acqua ossigenata è battericida solo per prevotella intermedia e per l’actinobacillus actinomicetemcomitans, e che il laser senza irriganti (a 2 watt di regolazione) è efficace solo su actinobacillus actinomicetemcomitans (quindi il laser è meno efficace del perossido di idrogeno). Tutti gli altri batteri dei complessi rosso ed arancione di Sokransky sono resistenti. L’associazione di laser e perossido di idrogeno ha invece dimostrato efficacia su tutti i batteri parodontopatogeni e, dagli ultimi test in vitro effettuati, anche sullo stafilococco aureo resistente agli antibiotici e responsabile delle infezioni cutanee nei pazienti defedati.
Il protocollo di Rey, 1992
Quindi il protocollo ideato dal Dr Rey nel 1992, denominato oggi “terapia fotodinamica senza colorante”, appare, alla luce della letteratura, efficace per trattare parodontiti refrattarie alle tradizionali metodiche.
Il protocollo operativo non chirurgico può così essere riassunto (figura 3):
- impiego di strumenti ultrasonici e irrigazione con soluzioni a base di polivinil-jodati (Betadine), con completo debridement della tasca parodontale/perimplantare;
- utilizzo di air flow con glicina o bicarbonato a bassa abrasività sulle superfici dentarie (sulle superfici esposte è preferibile usare polveri ad elevato potere abrasivo, in quanto l’obiettivo non è preservare la cellularità sulle superfici contaminate, ma decontaminare perfettamente le superfici infette);
- inserire l’acqua ossigenata al 3%, 10 volumi nella tasca parodontale/perimplantare e lasciare agire per almeno 2 minuti, eliminando l’eccesso con aspiratore chirurgico o tamponando con una compressa di garza sterile;
- dopo adeguata ossigenazione del difetto osseo parodontale/perimplantare e dei tessuti molli corrispondenti, si applica il laser a diodo (980 nm) con fibra da 400 micron, picco di potenza 2,5 W, ma con azzeramento dell’effetto termico (Ton del 20/30% e abbassamento della potenza media a 0,8W) per 60 secondi;
- al termine del trattamento consigliare al paziente di non risciacquare per mantenere in situ il sanguinamento conseguente all’effetto termico di vasodilatazione, di astenersi dalle manovre di igiene orale per almeno 6 ore, per poi riprendere i normali protocolli di igiene domiciliare.
Dagli studi condotti utilizzando tali protocolli e dai test in vivo e in vitro si è dimostrato utile inserire i protocolli laser assistiti all’interno della terapia parodontale non chirurgica, poiché risulta un trattamento pain free per il paziente, permette la gestione e il mantenimento di difetti complessi, riducendo del 90% la necessità di trattamento chirurgico, inquadrando il protocollo operativo in un’ottica di mini-invasività e limitando la necessità di somministrare antibiotici solo ai pazienti a rischio, riducendo quindi i rischi di fenomeni di antibiotico-resistenza.
Determinante è poi l’applicazione dei protocolli di igiene domiciliare e di terapia parodontale di sostegno, per il mantenimento dei risultati a lungo termine (figura 4).
I protocolli di igiene domiciliare associati e studiati in combinazione con la terapia laser assistita prevedono l’utilizzo di spazzolino e vibrazione sonica, scovolini interdentali e idropulsore, almeno due volte al giorno (mattina e sera). In aggiunta, nei casi di parodontite più aggravata, si prevede un guidato utilizzo di bicarbonato a bassa abrasività e bromelina in combinazione con acqua ossigenata 3%, 10 volumi per creare un impasto sostitutivo del dentifricio da utilizzare una volta al giorno durante il periodo in cui il paziente è sottoposto al trattamento in studio (deve poi essere sospeso per evitare che nel cavo orale possa avvenire un viraggio della flora batterica da Gram- a Gram+ con un aumentato rischio di carie radicolari nel medio/lungo periodo).
OHLLT (oxygen high level laser therapy) technology
La OHLLT (oxygen high level laser therapy) technology è una terapia fotodinamica senza colorante che comprende l’associazione di un laser penetrante con una soluzione di H2O2 modificata e stabilizzata con glicerol-fosfati (derivata dalla H2O2 10 volumi 3% quindi priva di azioni citotossiche, figura 5).
Come nella terapia fotodinamica senza colorante, ideata da Gerard Rey, l’energia laser attiva la soluzione di H2O2 modificata liberando radicali liberi e ossigeno singoletto che hanno attività antibatteriche sui gruppi Gram+ e Gram- specifici delle patologie parodontali. Il laser viene utilizzato con picchi di potenza elevati e potenza media ridotta (<0,8 watt). L’eliminazione dei residui d’argento dalla H2O2 e stabilizzazione con glicerolo-fosfati ha determinato, a parità di effetto battericida, un incremento della attività biostimolatoria che si traduce in una più rapida guarigione dei tessuti irradiati.

Lo schema prevede (figura 6):
- irradiazione laser di H2O2 stabilizzata (SiOxyl+ Solution)
- liberazione di molecole di H2O e ossigeno fondamentale (O2 ha 2 elettroni spaiati a spin parallelo)
- nuova irradiazione laser permette il passaggio di un elettrone ad un orbitale superiore con inversione dello spin che permette la liberazione di ossigeno singoletto
- l’ossigeno singoletto causa l’ossidazione delle membrane lipidiche dei batteri con conseguente morte dei batteri.
I meccanismi di distruzione cellulare durante la terapia fotodinamica sono messi in atto dall’ossigeno singoletto dei radicali liberi causando:
- denaturazione del DNA dei microrganismi
- distruzione della membrana lisosomiale
- alterazione delle funzioni mitocondriali
Il protocollo d’uso della terapia fotodinamica senza colorante e della OHLLT technology per il trattamento delle perimplantiti prevede:
- terapia non chirurgica, in caso di profondità di sondaggio inferiore a 5 mm e perdita di supporto osseo inferiore ai 2 mm o controindicazione/impossibilità di effettuare terapia chirurgica;
- terapia chirurgica, se profondità di sondaggio superiore a 5 mm e perdita di supporto osseo uguale o superiore ai 2 mm.
Quindi sono due i tipi di trattamento proposto: a cielo aperto e a cielo chiuso.
Una soluzione alternativa per eliminare i batteri anche in questi casi più complessi refrattari alle terapie convenzionali è proprio rappresentata dal protocollo OHLLT technology (decontaminazione con laser + perossido di idrogeno/SiOxyl+ solution). I cicli di decontaminazione laser vanno ripetuti finché non si elimina completamente il tessuto di granulazione (fino a quando la tasca risulta pulita e non si ha più fuoriuscita di tessuto di granulazione).
Il trattamento delle peri-implantiti mediante terapia fotodinamica senza colorante
Ecco schematicamente come procedere, nelle diverse visite programmate.
Prima visita
- Ottenere consenso informato
- Raccolta dati anamnestici
- Charting e sondaggio parodontale di tutte le tasche e recessioni gengivali
- Misurazione indici di placca e di sanguinamento
- Motivazione del paziente all’acquisto e all’utilizzo di tutti gli strumenti necessari al protocollo di igiene domiciliare
- Prelievo di fluido gengivale, colonizzato dai batteri e contenente cellule epiteliali, dalle tasche peri-implantari che verranno trattate tramite punte coniche di carta ed immediato invio al laboratorio di analisi microbiologiche
- Esecuzione degli esami radiologici immediati (Rx iuxtagengivali) e prescrizione di eventuali TC Cone Beam
Seconda visita (a una settimana dalla prima visita)
- Valutazione dei dati microbiologici arrivati dal laboratorio
- Anestesia plessica con mepivacaina e vasocostrittore (adrenalina 1:100.000)
- Trattamento parodontale completo non chirurgico di tutto il cavo orale secondo tecniche di parodontologia medicale laser-assistita (applicazione di betadine in rapporto 5 a 1 contestualmente al debridement delle tasche parodontali tramite ultrasuoni e curette, lucidatura delle superfici radicolari mediante air flow con polvere di bicarbonato di sodio a basso potere abrasivo o polvere di glicina, irrigazione delle tasche parodontali con la soluzione di perossido d’idrogeno stabilizzata, rimozione tramite aspirazione della soluzione in eccesso dal cavo orale; la soluzione di perossido viene lasciata ad agire nel difetto osseo per almeno 2 minuti al fine di consentire l’ossigenazione dei tessuti duri e molli, introduzione della punta del laser nelle tasche parodontali con la regolazione ed i tempi propri dell’OHLLT e descritta in seguito)
- Programmazione della seduta successiva ad una settimana
Terza visita (a una settimana dalla seconda visita)
- Valutazione dei dati microbiologici arrivati dal laboratorio
- Anestesia plessica con mepivacaina e vasocostrittore (adrenalina 1:100.000)
- Incisione di un lembo intrasulculare a tutto spessore sia vestibolare che linguale/palatale che si estende mesialmente e distalmente alle papille degli elementi adiacenti alla zona da trattare (figura 7a e 7b)
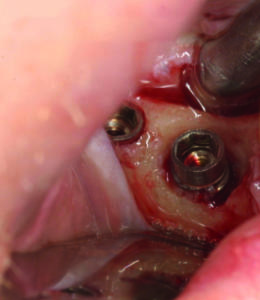
- Applicazione di betadine in rapporto 5 a 1 contestualmente al debridement della superficie implantare tramite ultrasuoni e curettes per rimuovere il tessuto di granulazione, ponendo grande attenzione a non incrementare la temperatura dei tessuti circostanti (figura 8)
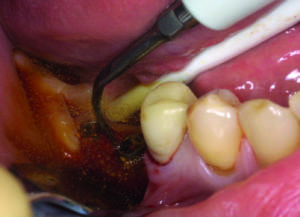
- Lucidatura della superficie mediante air flow con polvere di bicarbonato di sodio ad alto potere abrasivo, ponendo attenzione a proteggere i tessuti molli circostanti, in direzione apico-coronale, per azzerare il rischio di enfisemi dovuti all’alta pressione esercitata dall’air flow e allo scollamento delle fasce profonde
- Irrigazione dei difetti ossei perimplantari con la soluzione di perossido d’idrogeno stabilizzata o con acqua ossigenata 10 volumi 3%
- Rimozione tramite aspirazione della soluzione in eccesso dal cavo orale
- La soluzione di perossido viene lasciata ad agire nel difetto osseo per almeno 2 minuti al fine di consentire l’ossigenazione dei tessuti duri e molli
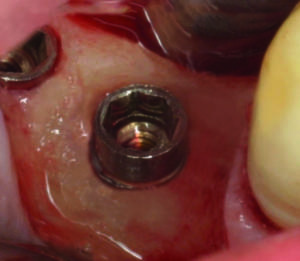
- Introduzione della punta del laser nel difetto osseo (figura 9)
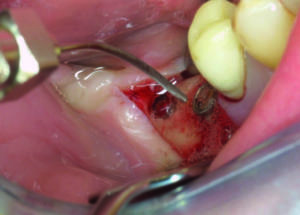
- Trattamento OHLLT technology con laser a diodi (regolazione “decontaminazione” cioè 2,5 watt potenza di cresta, T-on 20 microsecondi, T-off 80 microsecondi). La fluenza del laser è legata al tempo e alla potenza utilizzata. La potenza media del laser è di 0,5 watt, il tempo di applicazione è di 60 sec per lato e il diametro della fibra del laser è di 400 micron che corrispondono a 0,0012 cm2. Il laser viene applicato per 60 secondi sulla parete vestibolare e 60 secondi su quella palatale/linguale con un movimento oscillatorio continuo che va da distale a mesiale e viceversa
- Ripetizione del debridement della superficie con courettes e/o ultrasuoni fino ad eliminare ogni forma di placca o di tessuto di granulazione presente
- Chiusura del lembo tramite un filo di sutura in seta 4/0: un primo punto materassaio orizzontale interno (mattress suture) per far aderire bene i due lembi senza creare tensioni e più punti semplici.
- Quarta visita (a 15 giorni)
Rimozione punti di sutura e controllo ferita - Primo richiamo della terapia con applicazione della terapia fotodinamica per permettere una ulteriore decontaminazione. Se qualche area non è stata trattata completamente è possibile ripetere gli ultrasuoni veicolati con soluzione a base di polivinil-iodati (betadine).
Ai richiami, ogni 20 giorni, si applica acqua ossigenata 10 volumi 3% o stabilizzata (SiOxyl+ Solution) e laser (alle consuete regolazioni: 0,5 watt come potenza media, 2,5 watt come potenza di cresta o picco, frequenza 10.000 Hertz) ai difetti che permangono, per permettere una ulteriore decontaminazione e biostimolazione. Se qualche area non è stata trattata completamente è possibile ripetere gli ultrasuoni veicolati con soluzione a base di polivinil-iodati (betadine)-.
A 6 mesi si effettua il prelievo di fluido gengivale, colonizzato dai batteri e contenente cellule epiteliali, dalle tasche perimplantari trattate tramite punte coniche di carta ed immediato invio al laboratorio di analisi microbiologiche e si rimisurano tutti i parametri clinici (sondaggio, indice di placca e indice di sanguinamento. figura 10).
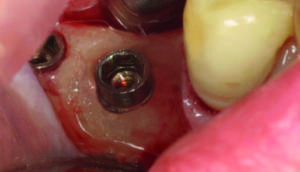
La maggior parte delle modalità di trattamento parodontale ha lo scopo di controllare la malattia riducendo la placca batterica sulla superficie delle radici e dei tessuti parodontali a livelli compatibili con l’abilità del sistema immunitario dell’ospite di controllarne la crescita. Negli studi in vivo effettuati con OHLLT per il trattamento delle parodontiti e delle perimplantiti si può evidenziare come la terapia fotodinamica OHLLT utilizzata come adiuvante alla terapia convenzionale porti a una diminuzione significativa dei ceppi batterici nel cavo orale.
Il nuovo protocollo potrebbe ovviare alla problematica della refrattarietà della malattia parodontale, in cui i batteri aggressivi colonizzatori della tasca parodontale riescono ad essere ridotti in misura maggiore che con qualunque altro tipo di approccio parodontale.
Si è vista una diminuzione importante della carica totale batterica grazie all’effetto decontaminante della OHLLT, si deve invece all’effetto biostimolatorio che agisce come una sorta di doping biologico il miglioramento dell’indice di sanguinamento che arriva al 75% e un sondaggio medio dei siti affetti che migliora in media di 1,2 mm circa.
Conclusioni
La maggioranza degli studi analizzati dimostra modesti effetti benefici del laser a impulsi in confronto alle terapie convenzionali (con strumentazione manuale e o a ultrasuoni) nel trattamento iniziale di pazienti con perimplantiti.
La terapia fotodinamica mediante OHLLT, per i presupposti biologici che la sostengono, e per i risultati preliminari ottenuti nel trattamento di parodontiti e perimplantiti, appare essere un buon coadiuvante al trattamento chirurgico delle perimplantiti; l’efficacia dell’utilizzo del protocollo proposto mette in luce il bisogno di poter agire sul sito in maniera meno traumatica possibile ma con un’efficacia tale da poter avere un reale miglioramento della condizione batterico/flogistica. La riduzione dell’infiammazione parodontale, con una diminuzione della profondità di sondaggio e dell’indice di sanguinamento e una massiva diminuzione della carica batterica in particolare di quei ceppi aggressivi che vengono spesso trovati nei siti affetti e non riescono ad essere debellati con i protocolli convenzionali, è suggestiva della potenziale efficacia di questo protocollo per il trattamento della malattia perimplantare. Sarà necessario implementare questo studio pilota con RCT e altre forme di ricerca meglio posizionate nella piramide dell’evidenza scientifica in odontoiatria.
Hai trovato questo focus interessante? Non perdere, domani, la parte sulla Applicabilità del laser a diodi in protesi.
- Adel R, Lekholm U et al. A study of osseointegrated implants in the treatment of the edentulous jaws. International Journal of Oral Surgery 1981; 6:387-399
- Albrektsson, T. & Isidor, F. Consensus report of session IV. In: Lang, N.P. & Karring, T., eds. Proceedings of the First European Workshop on Periodontology, 1994, pp. 365-369
- Alsaadi et al. Impact of local and systemic factors on the incidence of late oral implant loss. Clinical Oral Implants Research, 2008; 19: 670-6.
- Berglundh T, Lindhe J. Dimension of the periimplant mucosa. Biological width revisited. J Clin Periodontol. 1996 Oct;23(10):971-3.
- Brägger U, Karoussis I, Persson R, Pjetursson B, Salvi G, Lang N. Technical and biological complications/failures with single crowns and fixed partial dentures on implants: a 10-year prospective cohort study. Clin Oral Implants Res. 2005 Jun;16(3):326-34.
- Buser D, Martin W, Belser UC. Optimizing esthetics for implant restorations in the anterior maxilla: anatomic and surgical considerations. Int J Oral Maxillofac Implants. 2004;19 Suppl:43-61. Review.
- Buser D. Titanium for dental applications: implants with roughened surfaces. In: Brunette DM, Tengvall P, Textor M Caccianiga G, Rey G, Fumagalli T, Cambini A, Denotti G, Giacomello MS. Photodynamic therapy (association diode laser/hydrogen peroxide): evaluation of bactericidal effects on periodontopathic bacteria: an in vitro study. European Journal of Infiammation 2012
- Caccianiga G, Baldini A, Baldoni M, Tredici G. Application of laser in periodontology: microbiological evaluation with PCR-Real Time. Mediterranean Dental Implant Congress 2004
- Caccianiga G, Paiusco A, Fumagalli T, Cambini A, Giacomello MS. The use of laser diodes superpulses in implantology. European Journal of Infiammation 2012
- Caccianiga G, Urso E, Monguzzi R, Gallo K, Rey G. Efecto bactericida del laser de diodo en periodoncia. Av periodon implantol 2007
- Caccianiga G, Rey G, Baldoni M, Paiusco A (2016). Clinical, Radiographic and Microbiological Evaluation of High Level Laser Therapy, a New Photodynamic Therapy Protocol, in Peri-Implantitis Treatment; A Pilot Experience. Biomed Research International, vol. 2016, p. 1-8, ISSN: 2314-6133, doi: 10.1155/2016/6321906
- Caccianiga G, Baldoni M, Ghisalberti CA, Paiusco A (2016). A Preliminary In Vitro Study on the Efficacy of High-Power Photodynamic Therapy (HLLT): Comparison between Pulsed Diode Lasers and Superpulsed Diode Lasers and Impact of Hydrogen Peroxide with Controlled Stabilization. Biomed Research International, vol. Volume 2016, Article ID 1386158, p. 1-6, ISSN: 2314-6141, doi: http://dx.doi.org/10.1155/2016/1386158
- Caccianiga G, Rey G, Paiusco A, Lauritano D, Cura F, Ormianer Z, Carinci F (2016). Oxygen high level laser therapy is efficient in treatment of chronic periodontitis: a clinical and microbiological study using PCR analysis. Journal of Biological Regulrtors & Homeostatic Agents, vol. 30, p. 87-97, ISSN: 0393-974X
- Caccianiga G, Cambini A, Donzelli E, Baldoni M, Rey G, Paiusco A (2016). Effects of laser biostimulation on the epithelial tissue for keratinized layer differentiation: an in vitro study. Journal of Biological Regulrtors & Homeostatic Agents, vol. 30, p. 99-105, ISSN: 0393-974X
- Leonida A, Paiusco A, Rossi G, Carini F, Baldoni MG, Caccianiga G (2013). Effects of low-level laser irradiation on proliferation and osteoblastic differentiation of human mesenchymal stem cells seeded on a three-dimensional biomatrix: in vitro pilot study. Lasers in Medical Science, ISSN: 0268-8921, doi: 10.1007/s10103-012-1067-6
- Ericsson I, Berglundh T, Marinello C, Liljenberg B, Lindhe J. Long-standing plaque and gingivitis at implants and teeth in the dog. Clin Oral Implants Res. 1992 Sep;3(3):99-103.
- Ericsson I, Persson LG, Berglundh T, Marinello CP, Lindhe J, Klinge B. Different types of inflammatory reactions in peri-implant soft tissues. J Clin Periodontol. 1995 Mar;22(3):255-61.
- Etter TH, Håkanson I, Lang NP, Trejo PM, Caffesse RG. Healing after standardized clinical probing of the perlimplant soft tissue seal: a histomorphometric study in dogs. Clin Oral Implants Res. 2002 Dec;13(6):571-80.
- Evans CD, Chen ST. Esthetic outcomes of immediate implant placements. Clin Oral Implants Res. 2008 Jan;19(1):73-80.
- Evian CI, Emling R, Rosenberg ES, Waasdorp JA, Halpern W, Shah S, Garcia M. Retrospective analysis of implant survival and the influence of periodontal disease and immediate placement on long-term results. Int J Oral Maxillofac Implants. 2004 May-Jun;19(3):393-8.
- Felo A, Shibly O, Ciancio SG, Lauciello FR, Ho A. Effects of subgingival chlorhexidine irrigation on peri-implant maintenance. Am J Dent. 1997 Apr;10(2):107-10.
- Feloutzis A, Lang NP, Tonetti MS, Bürgin W, Brägger U, Buser D, Duff GW, Kornman KS. IL-1 gene polymorphism and smoking as risk factors for peri-implant bone loss in a well-maintained population. Clin Oral Implants Res. 2003 Feb;14(1):10-7.
- Ferreira SD, Silva GL, Cortelli JR, Costa JE, Costa FO. Prevalence and risk variables for peri-implant disease in Brazilian subjects. J Clin Periodontol. 2006 Dec;33(12):929-35.
- Fransson C, Wennström J, Tomasi C, Berglundh T. Extent of peri-implantitis- associated bone loss. J Clin Periodontol. 2009 Apr;36(4):357-63.