Patologie del cavo orale negli atleti
Concetti generali su anemia e stato infiammatorio transitorio negli atleti
Nel 1985, Taylor e collaboratori (1) misero in evidenza che negli atleti, dopo lo sforzo di una competizione, i parametri ematologici indicavano uno stato di carenza di ferro, testimoniato da una significativa diminuzione del ferro serico totale e della saturazione in ferro della transferrina. Questo stato patologico transitorio sembrava essere correlato ad un aumento significativo della proteina C-reattiva che indicava una fase infiammatoria acuta attribuibile ad un’ingiuria della muscolatura. Recentemente è stato dimostrato che lo stato di carenza del ferro in circolo è dovuto, invece, ad un più complesso meccanismo che coinvolge un disordine nel metabolismo del ferro associato ad uno stato infiammatorio.
Attualmente, tutti gli eventi che caratterizzano il metabolismo del ferro sono inclusi nella definizione omeostasi del ferro che consiste nella fisiologica ripartizione del ferro disponibile nelle cellule, nelle secrezioni e nel circolo e nell’assenza di fenomeni infiammatori. Ne consegue che un disordine nell’omeostasi del ferro è associato ad un sovraccarico di ferro nelle cellule e secrezioni, a una carenza di ferro in circolo e alla presenza di fenomeni infiammatori, non strettamente associati alla proteina C-reattiva, ma piuttosto ad una citochina pro-infiammatoria, l’IL-6 (2). Questa citochina modula l’espressione dei due più importanti fattori dell’omeostasi del ferro: l’epcidina e la ferroportina (Fpn).
L’epcidina, un peptide over-espresso dal fegato in presenza di IL-6 e secreto nel circolo e nelle urine, è in grado di formare un complesso con la Fpn (3). La formazione del complesso porta alla degradazione della Fpn, unica proteina finora nota per esportare il ferro dalle cellule al circolo. L’assenza di Fpn, dovuta sia alla degradazione che ad una sua down-espressione ad opera dell’IL-6, ha come conseguenza diretta l’impossibilità di esportare il ferro dalle cellule al circolo (4 e referenze incluse).
Mentre la concentrazione dell’epcidina nel circolo o nelle urine è stata ampiamente determinata (5, 6), l’espressione della Fpn è, ovviamente, dimostrabile solo in modelli in vitro (7, 8).
L’omeostasi sistemica del ferro è illustrata nella figura 1.
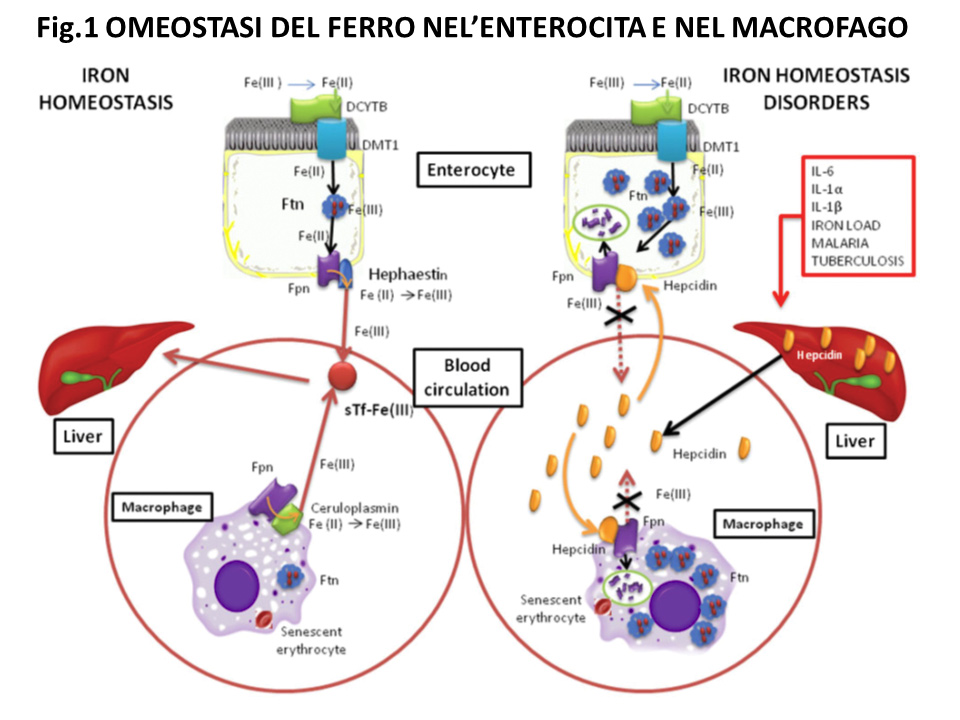
- In condizioni fisiologiche, il ferro giornalmente viene assorbito dagli enterociti duodenali (1-2 mg/giorno) attraverso la riduzione del ferro dallo stato ferrico (III) a quello ferroso (II) da parte di una reduttasi (duodenal cytochrome B, DCYTB) e la successiva penetrazione all’interno della cellula attraverso Divalent Metal Transporter 1 (DMT1). All’interno degli enterociti il ferro viene sequestrato dalla ferritina. Non esistendo una via di escrezione, il fabbisogno di ferro è modulato dalla ferritina che, dopo averlo sequestrato, in caso di necessità, lo cede nuovamente all’interno della cellula. Il ferro, derivante dalla ferritina, viene esportato al circolo attraverso la Fpn coadiuvata dall’efestina che ossida lo ione ferroso a ione ferrico per facilitarne il legame da parte della transferrina nel sangue. Ne consegue che il ferro non si accumula mai all’interno degli enterociti.
- È inoltre interessante notare che, ogni giorno, i macrofagi circolanti riciclano 20 mg di ferro derivante dalla lisi delle emazie senescenti attraverso il medesimo meccanismo descritto per gli enterociti (fig. 1). La Fpn dei macrofagi è supportata dalla ceruloplasmina che, similmente all’efestina, ossida gli ioni ferrosi (9).
- Da quanto riportato, è ovvio che lo stato patologico che comporta l’accumulo di ferro nelle cellule e secrezioni e la sua carenza in circolo, sia dovuto ad un disordine non solo della sintesi dell’epcidina ma anche della Fpn, provocato principalmente dall’IL-6 (fig. 1).
- L’accumulo di ferro nelle cellule/secrezioni facilita la colonizzazione batterica, la sintesi delle specie reattive dell’ossigeno (ROS) che contribuiscono all’aumento del processo infiammatorio e del danno cellulare. L’accumulo di ferro nei tessuti/secrezioni è ovviamente associato alla sua carenza in circolo (4).
- Questo meccanismo di escrezione o accumulo del ferro è espletato, a livello cellulare, non solo dagli enterociti e macrofagi, ma anche dalle cellule placentari ed epiteliali inclusi gli epiteli a livello delle mucose orali.
Atleti e Ferro
Recentemente è stato dimostrato che i disordini dell’omeostasi sistemica del ferro non sono dovuti ad una carenza di ferro nella dieta (inspiegabile nei paesi industrializzati e negli atleti) ma piuttosto ad una sua evidente delocalizzazione: sovraccarico del ferro nelle cellule epiteliali a livello delle mucose, nelle secrezioni ed una carenza di ferro in circolo (4 e referenze incluse).
Mentre, da tempo, è noto che, dopo un prolungato allenamento, le citochine pro-infiammatorie, inclusa IL-6, aumentano (10, 11), solo recentemente è stato scoperto che durante gli allenamenti, negli sportivi, si osserva un impressionante aumento della sintesi dell’epcidina che, come già riportato, è coinvolta nell’anemia (12, 13) e nella carenza di ferro in circolo (14). Pertanto, l’anemia transitoria, dimostrata negli atleti nel post esercizio o post gara, è dovuta ad un transitorio disordine dell’omeostasi del ferro e dell’infiammazione (15).
Occorre inoltre sottolineare che ancor più importante è il fatto del diverso fabbisogno di ferro tra le atlete e gli atleti rispetto ai non atleti (1-2 mg al giorno). Infatti, le atlete hanno un maggior fabbisogno di ferro rispetto agli atleti (18 mg/die rispetto a 8 mg/die) a causa delle perdite di sangue durante il ciclo mestruale (16). Questa carenza era classicamente ritenuta controbilanciabile con l’assunzione di cibi o bevande arricchite in ferro (17).
Tuttavia, a causa delle recenti scoperte che associano la carenza di ferro a fenomeni ben più complessi inclusi quelli infiammatori (18), la supplementazione orale di ferro non solo provoca numerosi effetti indesiderati (crampi, nausea, diarrea eccetera) ma non è efficace e può essere anche dannosa in quanto induce un aumento della sintesi delle citochine pro-infiammatorie inclusa l’IL-6 (4, 6, 14, 19) e dell’epcidina (12, 13) associata alla carenza di ferro in circolo (14).
Ne consegue che il ripristino dello stato carenziale di ferro può essere ottenuto solo attraverso sostanze che diminuiscano la sintesi dell’IL-6 e dell’epcidina e aumentino la sintesi della Fpn e non mediante somministrazione di ferro (4, 6, 14, 19, 20).
Per ciò che riguarda il dato, precedentemente riportato, che l’esercizio prolungato promuove disordini metabolici, come l’accumulo di ferro nelle cellule e nelle secrezioni, occorre ricordare che il ferro disponibile genera i pericolosi superossidi denominati anche radicali liberi o specie reattive dell’ossigeno (ROS), lo stress ossidativo e, conseguentemente, il danno cellulare.
È, pertanto, imperativo limitare gli effetti dannosi dei radicali liberi che, ovviamente, potrebbero aumentare in caso di somministrazione di ferro.
I sistemi anti-ossidanti nel nostro organismo sono rappresentati dagli enzimi (catalasi glutatione perossidasi, superossido dismutasi) e da sostanze come le vitamine E, A , C e glutatione.
Un disordine nel bilanciamento tra la produzione di radicali liberi e la presenza di anti-ossidanti porta sicuramente a uno stato di stress ossidativo che, negli atleti, è associato ad un maggiore affaticamento muscolare e a una scarsa resa atletica.
Atleti e preparati suggeriti quali integratori del loro stato carenziale
Nel 2009, al fine di ottenere un migliore recupero dall’affaticamento, Shing e collaboratori (21) dimostrarono che la somministrazione del colostro bovino, durante i periodi di intenso allenamento, ripristinava la sintesi dell’immunoglobulina A, testata nella saliva (IgAs).
Ovviamente, non essendo il colostro una sostanza pura ma un complesso di sali, proteine e peptidi con molteplici attività biologiche, è veramente difficile attribuire alla sua somministrazione una specifica efficacia.
Tuttavia, il colostro, oltre a fattori utili per lo sviluppo del neonato, contiene elevate concentrazioni di lattoferrina (Lf), la più importante proteina multifunzionale delle secrezioni, conosciuta da tempo svolgere un’attività anti-batterica e anti-ossidante grazie alla sua capacità di chelare due ioni ferrici per molecola (22). La Lf possiede anche un’importante azione anti-infiammatoria grazie alla sua capacità di legarsi al DNA nucleare inibendo la sintesi delle citochine pro-infiammatorie (4, 23).
Si vuole dare notevole importanza e richiamare fortemente l’attenzione sul fatto che si dovrebbero sempre valutare criticamente le proposte commerciali che indicano l’acquisizione di miscele di sostanze non ben definite, che il Ministero della Salute italiano tollera per gli integratori alimentari ma non sempre accetta per i prodotti farmaceutici.
Tutti noi dovremmo essere consci che l’indicazione di acquisire miscele e non prodotti puri, come peraltro richiede la Classificazione Europea degli Integratori Alimentari, è dettata il più delle volte da motivazioni commerciali che, non sempre, sono in funzione della salute umana.
Infatti, due principali motivi, in genere, sovrintendono alla commercializzazione delle miscele:
- evitare il costo di un corretto procedimento di purificazione del principio attivo;
- evitare denunce di contraffazione se la funzione rivendicata dalla miscela è identica a quella del principio attivo descritta in un brevetto concesso prima della commercializzazione della miscela.
L’acquisizione per os del colostro come pure di altre miscele derivate da latte bovino dovrebbe essere evitata perché, anche se i prodotti da acquisire sono naturali, l’assenza di un qualsiasi controllo e di un certificato d’analisi potrebbe esporre a rischi imprevisti l’atleta o chiunque ne faccia uso.
L’esempio, di seguito riportato, dimostra chiaramente ciò da cui si intende mettere in guardia l’utilizzatore.
Nei giocatori di basket, la Lf e le IgAs vengono saggiate nel periodo degli allenamenti, delle gare e 4 settimane dopo la gara. I risultati chiaramente dimostrano che la Lf e le IgAs diminuiscono nella saliva a causa della minor secrezione salivare sia durante gli allenamenti che nella gara. È pertanto importante ripristinare la concentrazione della Lf e delle IgAs mediante somministrazione di un prodotto che le contenga nelle dosi idonee a ristabilire la situazione fisiologica. Mentre la Lf estratta dal latte bovino ha una sequenza amino-acidica pressoché simile a quella umana ed è stata ampiamente studiata (24 e referenze incluse), non ci sono studi che dimostrino una similarità tra le IgAs umane e quelle bovine.
Inoltre, a conferma che anche altri fattori sono espressi diversamente durante una competizione sportiva, è stato osservato che il cortisolo salivare, ormone di fase acuta, aumenta (25) e solo una settimana dopo la gara inizia a diminuire. La correlazione inversa tra la diminuzione dell’IgAs e della Lf e l’aumento del cortisolo indicano un possibile ruolo del cortisolo nella diminuzione dell’immunità naturale (26). Mentre è stato ampiamente dimostrato che la Lf, nelle secrezioni, è il più importante fattore dell’immunità naturale con una potente attività anti-infiammatoria (22), non ci sono prove che il colostro bovino, che contiene livelli di Lf molto inferiori a quelli richiesti, influenzi nell’uomo l’immunità naturale e lo stato infiammatorio.
Atleti e Lattoferrina
Recentemente, la Lf sta emergendo come una proteina naturale molto efficace nella prevenzione e risoluzione dell’anemia (4) a cui, di diritto, negli atleti, va attribuito il recupero dall’affaticamento.
Dai dati riportati, appare chiaro come gli atleti, per il mantenimento della loro salute, necessitino di un maggior numero di controlli e di terapie mirate rispetto ai non atleti (27, 28, 29, 30, 31). Infatti, gli allenamenti intensi provocano, anche nei giovani atleti, un effetto così immunosoppressivo sull’immunità secretoria e sulla sintesi della Lf che, nel 2012, in occasione dei Giochi Olimpici di Londra, la salute del cavo orale fu verificata in numerosissimi atleti.
Atleti alle Olimpiadi di Londra del 2012 e loro stato di salute orale
I partecipanti alle Olimpiadi di Londra 2012 furono arruolati un giorno prima della cerimonia d’inaugurazione. Lo studio clinico terminò il giorno dopo la chiusura dei giochi olimpici. Provenivano dall’Africa, dall’Europa e dall’America e il 50% circa dichiarava di non essersi recato da dentisti o igienisti dentali negli ultimi 12 mesi, mentre l’8% di non aver mai ricevuto cure dentali. Il restante 40%, in relazione alla disciplina atletica, usava bite protettivi per la dentatura.
I risultati ottenuti hanno suggerito che allenamenti intensi provocano un effetto immunosoppressivo sull’immunità mucosale, soprattutto a carico della Lf, anche nei giovani atleti (32, 33).
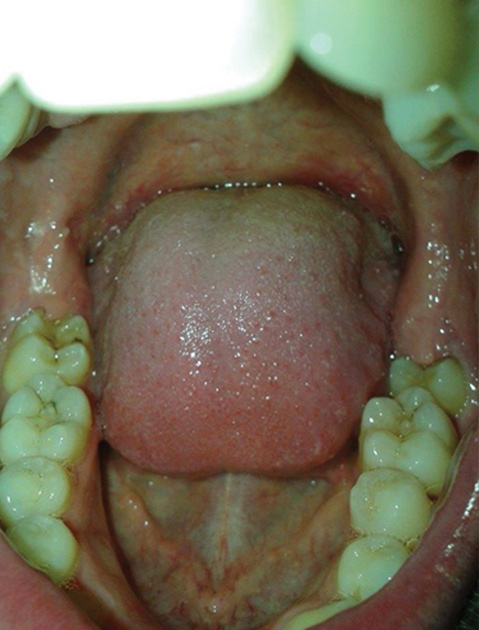
Il numero medio di denti per atleta era di 29,7 e più della metà dei soggetti esaminati presentava carie. L’erosione dentale era presente nel 44,6% degli atleti con distribuzione simile tra regioni posteriori e anteriori delle arcate dentarie. Le infiammazioni gengivali erano presenti nei tre quarti degli atleti e più del 15% mostravano parodontiti in fase avanzata con danni irreversibili. Segni di pericoroniti erano osservati nel 10% degli atleti di cui alcuni provavano dolore. Inoltre, più del 40% degli atleti riferivano di essere affetti da patologie del cavo orale, il 28% segnalava un impatto negativo sulla loro qualità di vita e il 18% sulle loro prestazioni atletiche.
Le patologie orali non erano associabili all’etnia, anche se gli atleti africani mostravano una maggior incidenza di parodontiti.
In sintesi, un’elevata e significativa incidenza di patologie a carico del cavo orale era osservata negli atleti partecipanti ai Giochi Olimpici di Londra. In sintesi, il 55% erano affetti da carie, il 45% da erosioni dentali, il 75% da gengiviti e 15% da parodontiti (32).
Questi studi sono stati molto importanti perché sono serviti a mettere in luce come i programmi di prevenzione della salute del cavo orale debbano essere implementati e come nei Giochi Olimpici debbano essere istituiti servizi per il controllo della salute del cavo orale degli atleti, le cui patologie incidono negativamente sulla performance atletica e sul training.
Atleti e patologie orali più frequenti
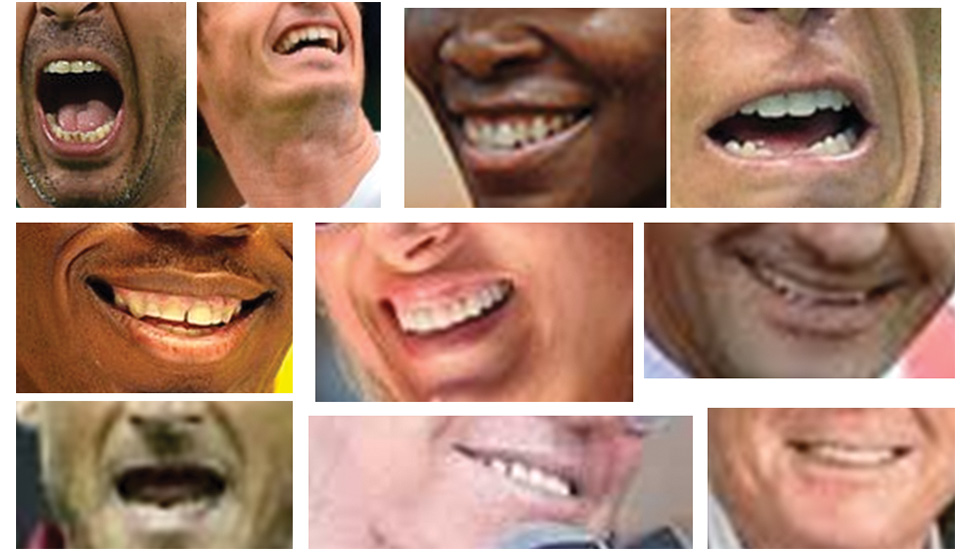
Nel 2014, Frese e collaboratori (33) dimostrarono anche che l’intensità e la durata del training influenzano la salute del cavo orale portando:
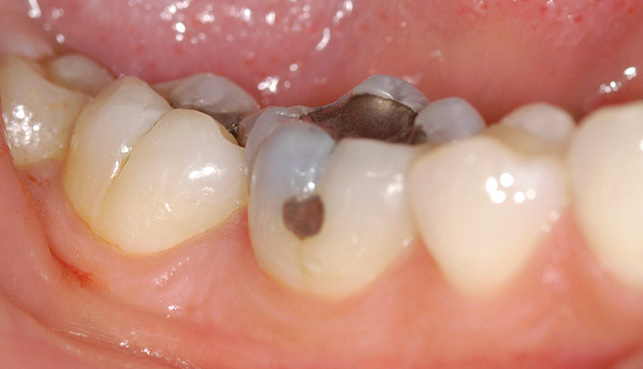
- alle carie (fig. 2);
- all’erosione dei denti (fig. 3);
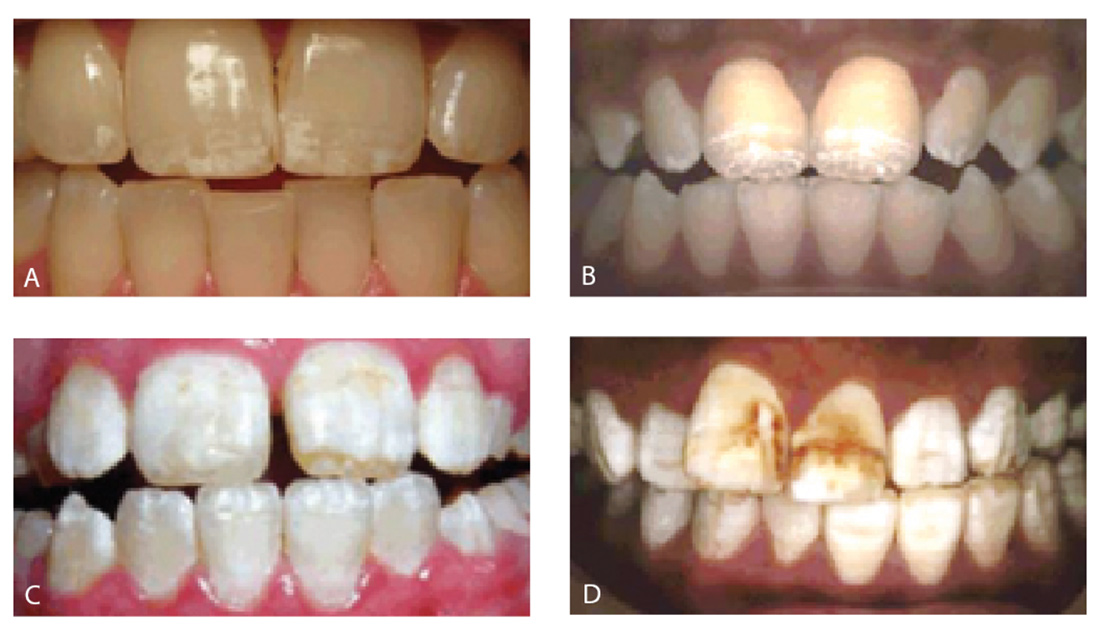
Figg. 3 Erosioni dentali: molto lieve (A), lieve (B), moderata (C) e severa (D). - alla gengivite (fig. 4);
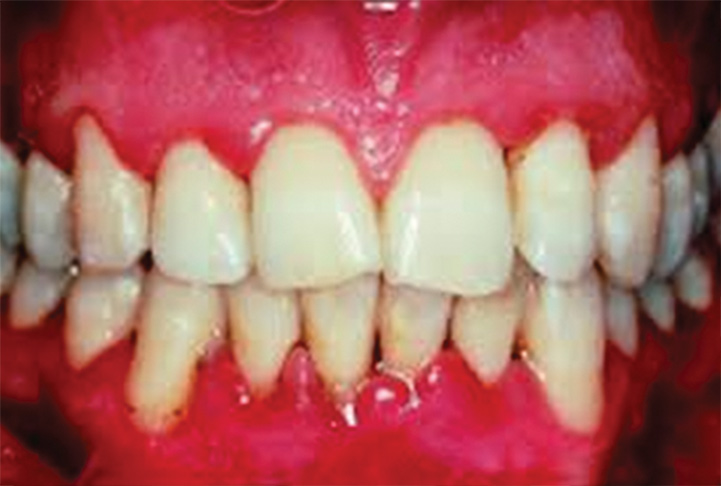
- alla parodontite (fig. 5);
- alla pericoronite (fig. 6);
- alla modifica dei parametri che caratterizzano lo stato fisiologico della saliva.
Tra gli atleti, infatti, era trovato un flusso salivare più elevato negli uomini rispetto alle donne e, conseguentemente, una diminuzione della Lf nelle atlete (tab. 1).
| Concentrazione della Lattoferrina salivare (microg/ml) | |||
|---|---|---|---|
| Uomini prima della gara | Uomini dopo la gara | Donne prima della gara | Donne dopo la gara |
| 36, 24 | 22.15 | 33.45 | 23.32 |
I valori della Lf, riportati nella tabella 1, potrebbero essere in accordo al dato sperimentale che evidenzia una maggiore suscettibilità alle infezioni nelle atlete rispetto agli atleti (He e collaboratori, 2014).
Inoltre, era stato osservato che la diminuzione del pH salivare, causata dai radicali acidi prodotti dall’utilizzo microbico di carboidrati presenti nelle bevande, favoriva l’erosione dei denti (33).
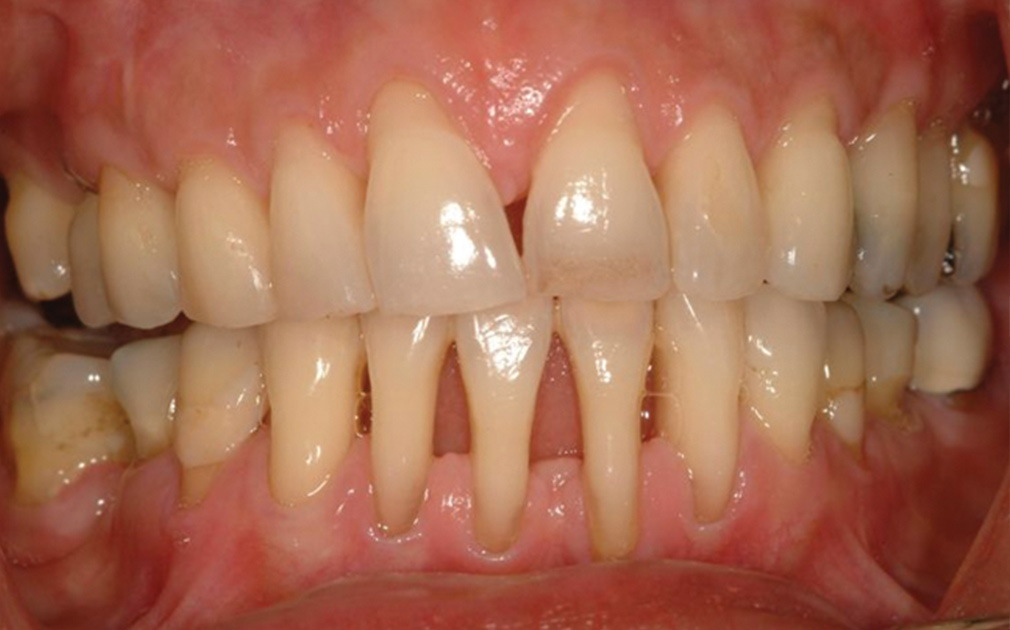
In sintesi, un cattivo stato di salute del cavo orale è molto comune negli atleti e, nonostante la loro giovane età, è significativamente peggiore rispetto ai non atleti (32) (figg. 7 e 8).
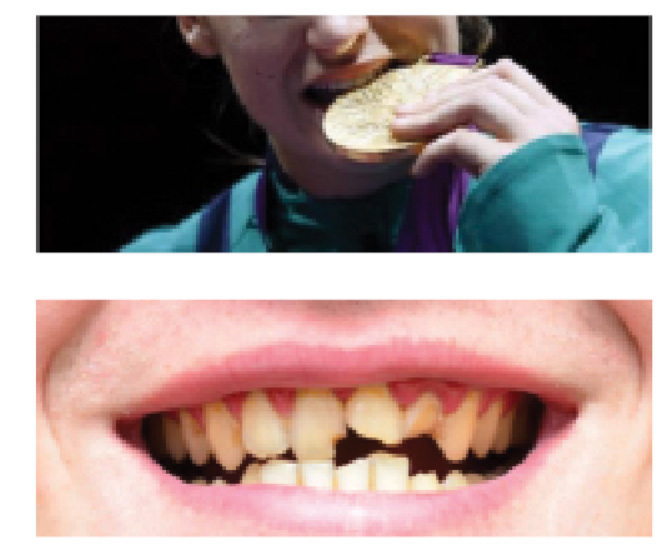
Occorre sottolineare, inoltre, che il ridotto flusso salivare negli atleti (34) comporta una diminuzione delle sostanze antimicrobiche presenti nella saliva che proteggono non solo l’habitat orale ma anche il tratto respiratorio superiore dall’ingiuria di microorganismi patogeni. Pertanto, la carenza di saliva, dimostrata negli atleti durante l’esercizio fisico e le competizioni, aumenta il rischio d’infezioni non solo nel cavo orale (35).
Atleti e Apporto nutrizionale
La dieta usuale, le bevande per gli atleti e i supplementi alimentari sono i maggiori determinanti di alcune patologie del cavo orale, incluse le carie, l’erosione dentale, le gengiviti e le periodontiti (figg. 2-5).
Come già detto, sia le bevande energetiche che i gel, frequentemente consumati durante gli allenamenti e le gare, contengono carboidrati dal 2% fino a più del 10% e vengono metabolizzate dai batteri fermentanti (Streptoccus spp) che, producendo radicali acidi come l’acido lattico, diminuiscono il pH della saliva aumentando così la suscettibilità degli atleti alle carie e all’erosione dentale.
La correlazione tra le carie ed il frequente uso delle bevande energetiche è stata osservata negli atleti di ogni età, dai bambini agli adulti, unitamente ad un aumento dello stato infiammatorio locale e sistemico durante gli allenamenti e le gare che, se diagnosticato, può rappresentare un segnale di allarme precoce di uno stato patologico.
Anche la disidratazione e l’essiccamento locale della bocca durante gli allenamenti e le gare unitamente alla diminuzione del flusso salivare danneggiano o addirittura annullano le proprietà immunologiche e protettive della saliva.
Le patologie descritte e gli interventi da eseguire nell’atleta inclusa la somministrazione di lattoferrina mediante compresse orosolubili, sono riportate nella tabella 2.
| Patologia | INTERVENTI |
|---|---|
| Erosione dentaria | Ridurre il consumo di bevande con elevato contenuto di carboidrati |
| Consumare soluzioni con 2% carboidrati e/o acqua | |
| Tenere pochissimo tempo la bevanda in bocca | |
| Acquisire durante gli allenamenti o le gare due compresse orosolubili contenenti 50 mg di lattoferrina per evitare lo sviluppo di batteri fermentanti che producono radicali acidi ed abbassano il pH della saliva | |
| Assumere dopo ogni accurata igiene orale una compressa orosolubile contenente 50 mg di lattoferrina per preservare la salute del cavo orale | |
| Carie | Ridurre il consumo di bevande con elevato contenuto di carboidrati |
| Consumare soluzioni con 2% carboidrati e/o acqua | |
| Tenere pochissimo tempo la bevanda in bocca | |
| Rimozione periodica professionale della placca sopragengivale | |
| Assumere, dopo ogni accurata igiene orale, una compressa orosolubile contenente 50 mg di lattoferrina per limitare l’eccesso di nuova placca | |
| Gengiviti | Ridurre il consumo di bevande con elevato contenuto di carboidrati |
| Consumare soluzioni con 2% carboidrati e/o acqua | |
| Tenere pochissimo la bevanda in bocca | |
| Rimozione periodica professionale della placca sopragengivale | |
| Acquisire durante gli allenamenti o le gare due o più compresse orosolubili contenenti 50 mg di lattoferrina per evitare fenomeni infiammatori e ripristinare la salivazione | |
| Assumere, dopo ogni accurata igiene orale, una compressa orosolubile contenente 50 mg di lattoferrina per limitare l’eccesso di nuova placca | |
| Parodontiti | Consumare soluzioni con 2% carboidrati e/o acqua |
| Tenere pochissimo la bevanda in bocca | |
| Rimozione periodica professionale della placca sottogengivale | |
| Acquisire durante gli allenamenti o le gare due o più compresse orosolubili contenenti 50 mg di lattoferrina per evitare fenomeni infiammatori e ripristinare la salivazione | |
| Assumere, dopo ogni accurata igiene orale, una compressa orosolubile contenente 50 mg di lattoferrina per limitare l’eccesso di nuova placca | |
| Pericoronite | Consumare soluzioni con 2% carboidrati e/o acqua |
| Tenere pochissimo tempo la bevanda in bocca | |
| Rimuovere periodicamente la placca sopragengivale | |
| Acquisire durante gli allenamenti o le gare due o più compresse orosolubili contenenti 50 mg di lattoferrina per evitare fenomeni infiammatori e ripristinare la salivazione | |
| Assumere, dopo ogni accurata igiene orale, una compressa orosolubile contenente 50 mg di lattoferrina per limitare l’eccesso di nuova placca | |
| Dopo il secondo episodio recidivante, rimuovere il molare |
Conclusioni
L’aumentata incidenza delle patologie del cavo orale negli atleti rispetto ai non atleti sottolinea ancora una volta come l’omeostasi sistemica del ferro sia un presupposto per il generale benessere dell’atleta ed un requisito indispensabile per una performance ottimale.
Non solo gli atleti professionisti ma anche tutti gli sportivi tendono a ottenere dal proprio corpo il livello massimo di prestazione e, per questo, sono pronti e disponibili ad assumere qualsiasi tipo di sostanze che effettivamente o in maniera fittizia e/o pericolosamente promettono miracoli.
Sarebbe sempre meglio evitare tutte quelle sostanze che promettono di far aumentare il proprio rendimento mentre in realtà sono inefficaci, o addirittura dannose.
A tal proposito, basti pensare a quei prodotti che, aumentando la sintesi dell’emoglobina e quindi dell’ossigenazione dell’atleta, aumentano il volume dei globuli rossi fino a farli aggregare rischiando la formazione di emboli.
I risultati ottenuti da numerosi studi, recentemente eseguiti al fine di valutare la salute del cavo orale negli atleti professionisti, hanno permesso di dare una risposta chiara ed esaustiva al fatto che gli atleti hanno una maggiore suscettibilità alle patologie orali rispetto ai non atleti.
Le patologie orali possono rappresentare un allarme precoce dello stato patologico degli atleti dovuto, prevalentemente, ai disordini dell’omeostasi del ferro e dell’infiammazione. Anche se questi disordini sono in genere transitori, non si può escludere che divengano persistenti in assenza di ogni prevenzione.
Una corretta prevenzione delle più frequenti patologie orali, come indicata nella tabella 2, attraverso l’acquisizione di sostanze naturali come la lattoferrina, dovrebbe essere seguita in modo da prevenire e curare la/le patologie emergenti e prevenirne ulteriori.
L’acquisizione giornaliera della lattoferrina, dopo ogni igiene orale e durante gli esercizi e le gare, inibisce contemporaneamente l’eccessiva replicazione batterica e la sintesi dell’IL-6, permettendo così il ripristino dell’assorbimento del ferro, del suo trasporto in circolo che evita gli stati carenziali di ferro testimoniati dal basso numero di globuli rossi e dalla diminuzione della concentrazione dell’emoglobina, del ferro serico totale e della ferritina serica.
È inoltre fondamentale osservare che l’acquisizione giornaliera della lattoferrina aumenta il numero dei globuli rossi e la concentrazione dell’emoglobina, del ferro serico totale e della ferritina serica senza mai aumentare il valore globulare e, quindi, senza mai predisporre alla formazione di emboli.
A differenza di altri dannosi prodotti che promettono l’aumento della sintesi dell’emoglobina ma aumentano pericolosamente il valore globulare, la lattoferrina è una proteina naturale multifunzionale che non induce reazioni avverse né aumenta patologicamente i parametri ematologici incluso il valore globulare (4, 14, 19).
Ne consegue che per mantenere lo stato di salute del cavo orale o più in generale l’omeostasi sistemica del ferro e dell’infiammazione, la lattoferrina è il candidato ideale che, senza effetti indesiderati, previene e cura non solo l’anemia ma anche le infezioni e le infiammazioni che incidono negativamente sulla salute, sulla performance e rendimento degli atleti (22, 23, 24 e manoscritto in preparazione).
- Taylor C, Rogers G, Goodman C, Baynes RD, Bothwell TH, Bezwoda WR, Kramer F, Hattingh J. Hematologic, iron-related, and acute-phase protein responses to sustained strenuous exercise. J Appl Physiol 1987 Feb;62(2):464-9.
- Nemeth E, Rivera S, Gabayan V, Keller C, Taudorf S, Pedersen BK, Ganz T. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest 2004 May;113(9):1271-6.
- De Domenico I, Ward DM, Musci G, Kaplan J. Evidence for the multimeric structure of ferroportin. Blood 2007 Mar;109(5):2205-9.
- Paesano R, Natalizi T, Berlutti F, Valenti P. Body iron delocalization: the serious drawback in iron disorders in both developing and developed countries. Pathog Glob Health 2012 Aug;106(4):200-16.
- Ganz T, Olbina G, Girelli D, Nemeth E, Westerman M. Immunoassay for human serum hepcidin. Blood 2008 Nov 15;112(10):4292-7.
- Paesano R, Berlutti F, Pietropaoli M, Goolsbee W, Pacifici E, Valenti P. Lactoferrin efficacy versus ferrous sulfate in curing iron disorders in pregnant and non-pregnant women. Int J Immunopathol 2010a Apr-Jun;23(2):577-87.
- Frioni A, Conte MP, Cutone A, Longhi C, Musci G, di Patti MC, Natalizi T, Marazzato M, Lepanto MS, Puddu P, Paesano R, Valenti P, Berlutti F. Lactoferrin differently modulates the inflammatory response in epithelial models mimicking human inflammatory and infectious diseases. Biometals 2014 Oct;27(5):843-56.
- Cutone A, Frioni A, Berlutti F, Valenti P, Musci G, Bonaccorsi di Patti MC. Lactoferrin prevents LPS-induced decrease of the iron exporter ferroportin in human monocytes/macrophages. Biometals 2014 Oct;27(5):807-13.
- De Domenico I, Ward DM, Langelier C, Vaughn MB, Nemeth E, Sundquist WI, Ganz T, Musci G, Kaplan J. The molecular mechanism of hepcidin-mediated ferroportin down-regulation. Mol Biol Cell 2007;18(7):2569–78.
- Ostrowski K, Rohde T, Asp S, Schjerling P, Pedersen BK. Chemokines are elevated in plasma after strenuous exercise in humans. Eur J Appl Physiol 2000;84(3):244–5.
- Ostrowski K, Rohde T, Asp S, Schjerling P, Pedersen BK. Pro- and anti-inflammatory cytokine balance in strenuous exercise in humans. J Physiol 1999;515:287-91.
- Roecker L, Meier-Buttermilch R, Brechtel L, Nemeth E, Ganz T. Iron-regulatory protein hepcidin is increased in female athletes after a marathon. Eur J Appl Physiol 2005;95:569–71.
- Newlin MK, Williams S, McNamara T, Tjalsma H, Swinkels DW, Haymes EM. The effects of acute exercise bouts on hepcidin in women. Int J Sport Nutr Exerc Metab 2012;22:79-88.
- Paesano R, Berlutti F, Pietropaoli M, Pantanella F, Pacifici E, Goolsbee W, Valenti P. Lactoferrin efficacy versus ferrous sulfate in curing iron deficiency and iron deficiency anemia in pregnant women. Biometals 2010b Jun;23(3):411-7.
- Latunde-Dada GO. Iron metabolism in athletes--achieving a gold standard. Eur J Haematol 2013 Jan;90(1):10-15.
- Harvey LJ, Armah CN, Dainty JR, Foxall RJ, John LD, Langford NJ, Fairweather-Tait SJ. Impact of menstrual blood loss and diet on iron deficiency among women in the UK. Br J Nutr 2005;94:557-64.
- Deldicque L, Francaux M. Recommendations for healthy nutrition in female endurance runners: an update. Frontiers in Nutrition May 2015;2; Article 17.
- Peeling P, Dawson B, Goodman C, Landers G, Trinder D. Athletic induced iron deficiency: new insights into the role of inflammation, cytokines and hormones. Eur J Appl Physiol 2008;103:381-91.
- Paesano R, Pietropaoli M, Gessani S, Valenti P. The influence of lactoferrin, orally administered, on systemic iron homeostasis in pregnant women suffering of iron deficiency and iron deficiency anaemia. Biochimie 2009 Jan;91(1):44-51.
- Paesano R, Torcia F, Berlutti F, Pacifici E, Ebano V, Moscarini M, Valenti P. Oral administration of lactoferrin increases hemoglobin and total serum iron in pregnant women. Biochem Cell Biol 2006 Jun;84(3):377-80.
- Shing CM, Hunter DC, Stevenson LM. Bovine colostrum supplementation and exercise performance: potential mechanisms. Sports Med 2009;39(12):1033-54.
- Valenti P, Antonini G. Lactoferrin: an important host defence against microbial and viral attack. Cell Mol Life Sci 2005 Nov;62(22):2576-87.
- Berlutti F, Pilloni A, Pietropaoli M, Polimeni A, Valenti P. Lactoferrin and oral diseases: current status and perspective in periodontitis. Ann Stomatol 2011;2(3-4):10-8.
- Valenti P. Lattoferrina e cavo orale. Doctor Os 2016 Mar;27(3):197-209.
- He CS, Tsai ML, Ko MH, Chang CK, Fang SH. Relationships among salivary immunoglobulin A, lactoferrin and cortisol in basketball players during a basketball season. Eur J Appl Physiol 2010 Nov;110(5):989-95.
- Li TL, Lin HC, Ko MH, Chang CK, Fang SH. Effects of prolonged intensive training on the resting levels of salivary immunoglobulin A and cortisol in adolescent volleyball players. J Sports Med Phys Fitness 2012 Oct;52(5):569-73.
- Piccininni PM, Fasel R. Sports dentistry and the Olympic Games. J Can Dent Assoc 2005;33:471–83.
- Vougiouklakis G, Tzoutzas J, Farmakis ET, Farmakis EE, Antoniadou M, Mitsea A. Dental data of the Athens 2004 Olympic and Paralympic Games. Int J Sports Med 2008;29:927-93.
- Yang XJ, Schamach P, Dai JP, Zhen XZ, Yi B, Liu H, Hu M, Clough T, Li Y, Ma CM. Dental service in 2008 Summer Olympic Games. Br J Sports Med 2011;45:270-4.
- Forrest JO. Dental condition of Olympic Games contestants—a pilot study, 1968. Dent Pract Dent Rec 1969;20:95-101.
- Soler BD, Batchelor PA, Sheiham A. The prevalence of oral health problems in participants of the 1992 Olympic Games in Barcelona. Int Dent J 1994;44:44-8.
- Needleman I, Ashley P, Petrie A, Fortune F, Turner W, Jones J, Niggli J, Engebretsen L, Budgett R, Donos N, Clough T, Porter S. Oral health and impact on performance of athletes participating in the London 2012 Olympic Games: a cross-sectional study. Br J Sports Med 2013 Nov;47(16):1054-8.
- Frees C, Frese F, Kuhlmann S, Saure D, Reljic D, Staehle HJ, Wolff D. Effect of endurance training on dental erosion, caries, and saliva. Scand J Med Sci Sports 2015 Jun;25(3):e319-26.
- Mulic A, Tveit AB, Songe D, Sivertsen H, Skaare AB. Dental erosive wear and salivary flow rate in physically active young adults. BMC Oral Health 2012;12:8.
- Kunz H, Bishop NC, Spielmann G, Pistillo M, Reed J, Ograjsek T, Park Y, Mehta SK, Pierson DL, Simpson RJ. Fitness level impacts salivary antimicrobial protein responses to a single bout of cycling exercise. Eur J Appl Physiol 2015 May;115(5):1015-27.
* Dipartimento di Sanità Pubblica e Malattie Infettive
** Dipartimento di Medicina interna e Specialità mediche
*** Dipartimento di Scienze Odontostomatologiche e Maxillo Facciali