Patologie del cavo orale: terapie classiche ed innovative nella cura delle gengiviti
L’infiammazione gengivale è associata a numerosi disordini del cavo orale come l’alitosi, le gengiviti e le parodontiti dovute all’accumulo della placca (batteri in biofilm) e alla formazione di tasche gengivali e parodontali. Questo disordine delle mucose, dovuto nelle sue fasi iniziali ad una mancata rimozione giornaliera della placca, è in genere trattato insegnando al soggetto una più accurata igiene orale e l’uso di dentifrici e collutori ad attività antibatterica. Una pulizia dentale professionale è inoltre particolarmente indicata quando l’infiammazione delle gengive dipende da concrezioni di placca e tartaro sopra e sottogengivale. In questi casi, il soggetto trattato può venire anche sottoposto a terapie antibatteriche che, tuttavia, rischiano di selezionare un microbiota orale resistente agli agenti antibatterici utilizzati e di modificare o eliminare i batteri commensali che, invece, rappresentano un’importante protezione dall’ingiuria di microorganismi (batteri e miceti) e virus patogeni.
I batteri commensali, infatti, non sono in grado di provocare un’infiammazione patologica, sia per loro caratteristiche intrinseche, sia per la risposta degli epiteli dell’ospite.
Nelle tabelle 1 e 2 sono riassunte le caratteristiche principali dei batteri commensali e patogeni in stretto riferimento alla risposta più o meno infiammatoria degli epiteli dell’ospite.
Come riportato, sia per le caratteristiche intrinseche dei batteri commensali sia per la permissività delle cellule dell’ospite (tab. 1), le mucose orali in situazioni fisiologiche non sono infiammate ma pronte a combattere le infezioni da batteri patogeni grazie alla loro attivazione attraverso l’infiammazione fisiologica: “se vuoi la pace, prepara guerra” (1).
| infiammazione fisiologica | |
|---|---|
| Caratteristiche dei batteri commensali | Risposta degli epiteli ai batteri commensali |
| Batteri Gram-positivi e Gram-negativi | Scarsa o assente risposta ai commensali |
| Il lipopolisaccaride dei batteri Gram-negativi commensali è meno tossico di quello dei batteri Gram-negativi patogeni | Scarsa espressione dei recettori per i batteri |
| Aderiscono al dente | Scarsa espressione dei recettori per il lipopolisaccaride |
| Aderiscono alla parte apicale delle cellule | |
| Non hanno mai una localizzazione intracellulare | |
| Non producono tossine | |
Viceversa, i batteri patogeni in grado di penetrare all’interno delle cellule dell’ospite, causano l’insorgenza di un’infiammazione patologica da parte degli epiteli a livello delle mucose orali con conseguente danno cellulare (tab. 2).
| infiammazione patologica con danno tessutale | |
|---|---|
| Caratteristiche dei batteri patogeni | Risposta degli epiteli ai batteri patogeni |
| Il lipopolisaccaride dei batteri Gram-negativi patogeni è più tossico di quello dei batteri Gram-negativi commensali | Elevata risposta ai patogeni |
| Aderiscono al dente | Elevata espressione dei recettori per i batteri |
| Aderiscono al dente | Elevata espressione dei recettori per il lipopolisaccaride |
| Aderiscono alla parte apicale delle cellule | Elevata sintesi di citochine pro-infiammatorie |
| Sono intracellulari | |
| Producono tossine | |
Come è noto, i batteri possono esistere in forma planctonica o sessile. In particolare nel cavo orale, nella forma planctonica sono liberamente sospesi o al massimo aggregati nella saliva con cui vengono ingoiati, mentre nella forma sessile sono adesi sia alla superficie abiotica rappresentata dai denti che alla superficie cellulare rappresentata dagli epiteli a livello delle mucose orali. Dopo l’adesione, i batteri, definiti in forma sessile, sono ricoperti da un esopolisaccaride sintetizzato da loro stessi, formando il così detto biofilm (insieme dei batteri ricoperti dall’esopolisaccaride) (fig. 1). Nell’uomo, la placca dentale è formata da batteri adesi in biofilm che si riformano subito dopo un’accurata igiene orale.
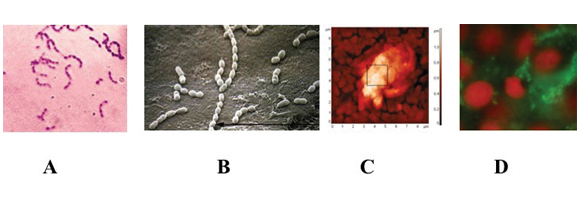
Streptococcus mutans in forma planctonica (A), adeso ad una superficie abiotica (B), adeso in biofilm ad una superficie abiotica (C) e adeso in biofilm ad una superficie cellulare (D ).
Le immagini sono state ottenute con diversi tipi di microscopia. A: microscopia ottica, B: microscopia elettronica a trasmissione, C: microscopia atomica, D: microscopia a fluorescenza.
Ne consegue che se un soggetto che non esegue una corretta igiene orale, nonostante si sottoponga a una pulizia dentale professionale, subirà, in tempi più o meno brevi, nuovi processi infiammatori dovuti alla formazione di un’abbondante placca batterica.
Gengiviti
La gengivite è la forma più lieve della malattia parodontale in quanto non danneggia le strutture di supporto del dente ed è reversibile. È causata da batteri in biofilm, presenti nella placca dentale, che si accumulano sulla superficie del dente adiacente alla gengiva. L’accumulo della placca, in assenza di una corretta rimozione quotidiana, la formazione del tartaro, le anomalie morfologiche o strutturali dei denti, le fratture radicolari e le ricostruzioni dentali incongrue sono le cause più frequenti dell’insorgenza delle gengiviti (2). Infatti, l’accumulo di placca lungo il margine gengivale, associata a batteri Gram-positivi anaerobi facoltativi come Streptococcus spp e Actinomyces spp scatena una reazione infiammatoria dei tessuti molli che espone la base dei denti ad un’ulteriore aggressione batterica. L’infiammazione determina, inoltre, edema, aumento della pressione del microcircolo con conseguente insorgenza di rossore, calore e dilatazione capillare. Tutti questi fattori facilitano il sanguinamento.
Il cavo orale di individui che non praticano una buona igiene orale può essere colonizzato, come già riportato (3), da microorganismi patogeni che provocano infezioni ben più severe come quelle endodontiche, quelle purulente, croniche e granulomatose (actinomicosi) e quelle associate ad endocarditi (4, 5). La persistenza dei patogeni può anche portare ad una loro diffusione nel circolo, nel cervello, nel fegato e nei polmoni (4, 6, 7). Ne consegue che l’assenza di corrette procedure igieniche aumenta significativamente non solo il rischio dell’insorgenza di gengiviti, ma influenza negativamente lo stato di salute dell’individuo.
Differentemente dalla parodontite che danneggia il tessuto connettivo e osseo e porta alla perdita dell’attacco del dente, la gengivite danneggia solamente i tessuti molli ed è una patologia che, come già detto, può revertire. Tuttavia, se trascurata, spesso precede le parodontopatie. La transizione dalle gengiviti alle parodontiti è molto frequente ma, ad oggi, non è stata ancora completamente compresa rendendo così difficile la prevenzione. Infatti, se da una parte le gengiviti sono considerate come un fattore di rischio per l’instaurarsi delle parodontiti (8), studi clinici hanno dimostrato che in alcuni individui le gengiviti non progrediscono mai a parodontiti (9).
La diagnosi di gengivite è effettuata dal dentista o dall’igienista dentale sulla base dei sintomi riportati dal paziente e dopo aver effettuato l’esame di denti, gengive, bocca e lingua.
Una variante, fortunatamente molto rara, denominata gengivite ulcerativa necrotizzante, colpisce, in forma acuta e a volte ricorrente, adolescenti e giovani adulti sottoposti a continui stress psicologici (10). Essa è caratterizzata da un’abbondante placca batterica e da una sintomatologia aggravata da dolore e sanguinamento spontaneo, dovuta a ulcerazioni e necrosi del tessuto gengivale. La sua frequenza varia dallo 6,7% negli studenti in paesi in via di sviluppo allo 0,001% in quelli in paesi industrializzati (11). Anche la malnutrizione e stati carenziali di vitamina C, B2 e B12 favoriscono l’insorgere della gengivite soprattutto nei paesi in via di sviluppo (11).
Anche gli ormoni favoriscono e aggravano le patologie gengivali associate soprattutto alla pubertà, alla gravidanza e al ciclo mestruale in cui si evidenzia un’iperplasia dei tessuti molli gengivali (12). Recettori per gli androgeni, estrogeni e progesterone sono presenti nel tessuto gengivale e hanno severi effetti sulle mucose e sul parodonto. Nella pubertà, cambi nel livello del testosterone nei maschi e dell’estradiolo nelle femmine (13) influenzano la permeabilità dei tessuti, diminuiscono la cheratinizzazione dell’epitelio gengivale e aumentano l’infiammazione gengivale indipendentemente dalla quantità di placca batterica (14).
In sintesi, le gengiviti sono caratterizzate da flogosi dei tessuti molli, rossore, edema, sanguinamento, alterazione del contorno gengivale, incremento di flusso del fluido crevicolare ed accumulo della placca batterica con conseguente alterazione patologica dei tessuti, senza perdita dell’attacco del dente.
Le gengiviti vengono classificate come acuta (diffusa, localizzata, marginale, papillare, ricorrente), cronica (cronica iperplastica) e necrotizzante ulcerativa. Tra le cause possono anche essere incluse: uso di farmaci, reazioni allergiche (plasmacellule), granulomatose, fibromatose, dermatosi (desquamativa) e infezioni virali da HSV e HIV.
Ovviamente, come già riportato, rimuovere la placca o limitarne quotidianamente lo sviluppo, mediante una corretta igiene orale, sono le migliori procedure per evitare la gengivite e le ulteriori complicazioni che ne possono derivare.
Di seguito viene riportata una sintesi delle procedure generalmente adottate nella cura delle gengiviti.
Rimozione della placca.
Uso di dentifrici, collutori ed antibiotici nella cura della gengivite: limiti e rischi
Nelle fasi precoci, un’accurata igiene orale può far regredire l’infiammazione, mentre nelle fasi tardive bisogna ricorrere al dentista per rimuovere la placca, il tartaro e per correggere eventuali ricostruzioni dentali incongrue. Nonostante la rimozione della placca, in genere, le gengiviti tendono a recidivare.
I dentifrici a base di proteine salivari addizionate del sistema lattoperossidasi-tiocianato sono da evitare in quanto, inducendo un aumento della produzione del perossido d’idrogeno del 60%, se da una parte eliminano i batteri sensibili al perossido d’idrogeno (acqua ossigenata), dall’altra danneggiano gli epiteli buccali, selezionando, altresì, un microbiota resistente al perossido d’idrogeno.
Per ciò che riguarda l’uso di antibiotici e/o collutori, è ben noto che non solo non hanno efficacia nel rimuovere il biofilm batterico della placca sopra gengivale ma, pericolosamente, selezionano un microbiota resistente agli agenti antibatterici utilizzati, danneggiando il microbiota commensale, importante barriera contro l’ingiuria di microorganismi patogeni e virus.
La somministrazione di Lactobacillus reuteri contro la gengivite: innovazione e dati contraddittori sull’efficacia
Di seguito vengono elencate le caratteristiche di Lactobacillus reuteri che ne rendono, al momento, poco chiari i benefici e l’efficacia di una somministrazione per os.
Criticismi
- Lactobacillus reuteri è un batterio anaerobio facoltativo, acidofilo e acidogenico che, replicandosi, produce acido lattico che, pericolosamente, abbassa il pH della saliva favorendo la carie e l’erosione dello smalto.
- In letteratura, i dati sull’uso di Lactobacillus reuteri nella cura delle patologie orali sono contraddittori in quanto, se da una parte viene consigliato per correggere la disbiosi del microbiota orale, dall’altro se ne sconsiglia l’uso a causa della sua influenza nell’acidificazione della saliva e della conseguente erosione dello smalto e formazione delle carie.
- Lactobacillus spp in forma liofilizzata, nel tempo tende ad aggregarsi, perdendo così la sua efficacia nel ripristino del normale microbiota orale. Infatti, gli aggregati microbici vengono ingoiati prima che possano aderire sia alla superficie del dente che alle mucose. Questo meccanismo disattende l’efficacia di adesione alle superfici dentali e alle mucose, importante caratteristica per il ripristino del normale microbiota orale.
- Lactobacillus reuteri produce una sostanza, la reuterina, in grado di svolgere un’attività antimicrobica verso Streptococcus mutans, Streptococcus gordonii, Actinomyces naeslundii e Tannerella forsythia. Tuttavia, la reuterina viene sintetizzata a seguito al metabolismo del glicerolo e del glucosio, aumentando così il rischio di acidificazione della saliva con conseguente erosione dello smalto e formazione delle carie.
- Essendo il cavo orale colonizzato da più di 600 specie commensali, non è chiaro il motivo della scelta di somministrare Lactobacillus reuteri che, invece, dovrebbe essere evitato o sostituito, eventualmente, con altri commensali.
- Va inoltre sottolineato che la concentrazione di Lactobacillus reuteri nel microbiota orale è significativa nel primo anno di vita a causa della lattazione, mentre successivamente tende a diminuire e certamente non è il batterio commensale più significativo. Così, la somministrazione giornaliera di più di 200 milioni di questi batteri può portare ad un disbiosi del microbiota stesso e non ad un suo ripristino.
- La colonizzazione orale di Lactobacillus reuteri non è permanente e questo spiega la necessità di una sua somministrazione giornaliera per prolungati periodi di tempo.
- Lactobacillus reuteri, anche se non sintetizza elevate concentrazioni di esopolisaccaridi, vivendo però anch’esso in biofilm, invece di svolgere un’azione antinfiammatoria, può indurre un processo infiammatorio. È universalmente noto che una delle più importanti cause dell’infiammazione gengivale è rappresentata proprio dal biofilm.
- Nelle prime fasi di somministrazione di Lactobacillus reuteri si osservano, infatti, fenomeni infiammatori che decrescono, ma in tempi lunghissimi (un anno di trattamento).
- I lavori in vivo sull’efficacia di Lactobacillus reuteri, anch’essi molto contraddittori, sono stati principalmente eseguiti analizzando il microbiota intestinale e non quello orale.
- Poche e conflittuali pubblicazioni riportano i risultati ottenuti in vivo sull’efficacia della somministrazione di Lactobacillus reuteri nella cura delle patologie del cavo orale.
- Dati sull’attività antinfiammatoria nel cavo orale non sono riportati e l’attività antiinfiammatoria di Lactobacillus reuteri dimostrata nell’intestino non può essere estrapolata per il cavo orale.
La somministrazione della lattoferrina nella cura delle gengiviti: Innovazione ed efficacia
Recentemente è emersa l’efficacia, nella cura delle gengiviti, di un nuovo trattamento basato sulla somministrazione della lattoferrina in soggetti affetti da questa patologia (12, 15).
Di seguito viene descritta la terapia innovativa eseguita mediante somministrazione di lattoferrina nel cavo orale.
Trattamento
Dopo accurata igiene orale, si consiglia di acquisire una compressa contenente 50 mg di lattoferrina e lasciarla dissolvere nella saliva senza masticare. La saliva deve essere ingoiata come accade normalmente. Infatti, ogni giorno circa 1.500 ml di saliva vengono sintetizzati dalle ghiandole salivari ed ingoiati. La bocca non deve essere sciacquata per almeno 15 minuti dopo l’assunzione di ogni compressa.
La durata del trattamento con la lattoferrina dipende dalla severità dell’infiammazione. Se trattata precocemente può richiedere da pochi giorni fino ad una settimana di terapia, se trattata tardivamente può richiedere fino ad un mese di terapia. In ogni caso, quando il paziente osserva per 3 giorni consecutivi la scomparsa della dolenzia nella masticazione e del sanguinamento la terapia può essere interrotta.
Dosaggio
La terapia può essere effettuata acquisendo una compressa orosolubile 2-4 volte al giorno a seconda della severità della patologia sempre dopo un’accurata igiene orale.
Già nei primi giorni di somministrazione della lattoferrina, il paziente riferisce la scomparsa della dolenzia e del sanguinamento ed il dentista verifica che le gengive sono molto meno infiammate.
Resta da sottolineare che, essendo la gengivite un’infezione/infiammazione recidivante, qualora recidivi anche dopo il trattamento di rimozione della placca effettuato da personale medico, il trattamento con la lattoferrina va eseguito immediatamente e cioè alla prima comparsa di sanguinamento, del rossore dei tessuti molli e della dolenzia durante la masticazione.
Criticismi ed effetti indesiderati
La somministrazione di lattoferrina va eseguita in assenza di una terapia marziale in quanto quest’ultima aumenta la sintesi delle citochine pro-infiammatorie, inclusa l’IL-6 (16, 17, 18).
La lattoferrina è un prodotto naturale, presente nella saliva dei soggetti sani, privo di effetti indesiderati e il trattamento può essere ripetuto più volte in un anno o per periodi anche molto lunghi.
La somministrazione della lattoferrina viene definita una terapia innovativa perché, a differenza delle altre basate sulla capacità di un prodotto di eliminare i batteri inclusi i commensali, preziosa barriera contro la colonizzazione dei patogeni, la lattoferrina non elimina i commensali della placca, ma ne modula la moltiplicazione, evitando così un’eccessiva formazione di placca che porterebbe alla ben nota infiammazione gengivale. Infatti, essendo la lattoferrina un naturale e primario componente dell’immunità naturale della saliva, i batteri commensali permangono vitali e non sono inibiti dalla sua presenza.
Inoltre, occorre porre attenzione al fatto che nessun composto, finora utilizzato nella cura delle gengiviti, svolge contemporaneamente molteplici attività: antibatterica, antibiofilm, anti formazione di radicali tossici dell’ossigeno e antinfiammatoria. Alla sua attività modulante la formazione della placca, va aggiunta la sua capacità di inibire la formazione del biofilm e la sua potente attività anti radicali tossici dell’ossigeno e antinfiammatoria fondamentale per evitare l’insorgenza di una infiammazione patologica dannosa per l’integrità degli epiteli.
Recentemente, è stata sottolineata l’importanza della diminuzione della concentrazione della lattoferrina nel cavo orale di soggetti affetti da patologie orali (14, 19), anche se questo risultato, in passato è stato contraddetto da altri autori .
La spiegazione dell’esistenza di questi dati contraddittori potrebbe risiedere nel fatto che la concentrazione della lattoferrina, nei vari distretti del cavo orale, varia al variare delle secrezioni analizzate ed è influenzata dalla quantità di fluido emesso, che a sua volta dipende dallo stato fisiologico o patologico del soggetto. In particolare, la concentrazione fisiologica della lattoferrina corrisponde a 1,23 mg/l nel fluido crevicolare, a 8,96 e 7,11 mg/l nella saliva non stimolata e stimolata. La saliva non stimolata è sintetizzata al 70% dalle ghiandole sottomandibolari, al 20% dalle parotidi e al 2% dalle sublinguali, mentre la saliva stimolata deriva al 30% dalle sottomandibolari e al 60% dalle parotidi (20).
Anche se la determinazione della concentrazione della lattoferrina nel cavo orale è un test diagnostico non invasivo e sembra di facile esecuzione (fig. 2), essa può essere influenzata da troppi fattori che la rendono molto variabile, poco ripetibile e affidabile.
Questo punto critico può, almeno in parte, spiegare i dati contraddittori sulla concentrazione della lattoferrina riportati da vari autori (14, 19, 21, 22, 23, 24). Infatti, la sua concentrazione mostra valori differenti se viene calcolata per sito o per ml. Nei soggetti sani, 36 ng/sito sono stati determinati rispetto a 63-90 ng/sito nei soggetti con gengiviti o parodontiti, mentre la sua concentrazione calcolata /ml è inferiore in condizioni patologiche (25).
Altro punto da tener presente è che la concentrazione della lattoferrina nella saliva oscilla anche in funzione dell’età del soggetto, in quanto la sua sintesi è sotto il controllo ormonale (26).
Inoltre, va sottolineato che la maggior parte dei lavori che riportano le concentrazioni della lattoferrina ignorano o non determinano correttamente la percentuale di saturazione in ferro della proteina (21, 22, 23, 24, 27). Infatti, come già riportato (3), la concentrazione di ferro disponibile aumenta con l’infiammazione ed il sanguinamento (presenza di emina) che è in grado di saturare tutti i siti di captazione del ferro della lattoferrina. La lattoferrina, completamente satura in ferro, non è più in grado di svolgere tutte le sue funzioni dipendenti dalla sua capacità di chelare il ferro (3).
In ogni caso, se veramente la sua concentrazione aumentasse nelle infezioni, anche a causa del richiamo dei neutrofili che la secernono attraverso i loro granuli, non si capirebbe il suo mancato funzionamento. Si deve, infatti, considerare che nei fenomeni infiammatori, i neutrofili vengono richiamati nei siti d’infezione/infiammazione dove secernono i granuli contenenti la lattoferrina, ma nelle infezioni ed infiammazioni la concentrazione di ferro disponibile aumenta e questo aumento porta ad una maggiore concentrazione di ferro legato alla proteina: dal 20% (nei soggetti sani) al 100% (nei soggetti malati) di saturazione in ferro. Anche se la lattoferrina aumenta la sua concentrazione, il fatto che abbia tutti i siti di captazione del ferro saturi indica che non è più in grado di sottrarre il ferro ai batteri e, quindi di svolgere un’attività antibatterica.
Si ritiene, pertanto, che nelle patologie del cavo orale, sia nei casi dove la lattoferrina è mancante o è completamente satura in ferro o è digerita dalle proteasi batteriche, un suo reintegro tramite somministrazione con compresse orosolubili può essere una strategia vincente.
Processi infiammatori avvengono comunemente nella cavità orale dovuti in larga parte ad infezioni microbiche. D’altra parte il microbiota orale è la comunità microbica più eterogenea del corpo umano e gioca, come già detto, un ruolo decisivo nell’evoluzione delle patologie gengivali soprattutto quando avvengono dei disordini nei meccanismi omeostatici tra il microbiota e l’ospite. Infatti, uno shift nella quantità e diversità della comunità microbica che colonizza la superficie del dente e delle mucose orali può portare ad un’infiammazione patologica mediata da un over produzione di citochine pro-infiammatorie.
Dal momento che è molto complesso determinare tutti i generi e le specie che costituiscono il microbiota orale anche alla luce del fatto che ancora non è noto quante di queste siano vitali ma non coltivabili, la determinazione quantitativa delle citochine pro-infiammatorie può essere un valido parametro sia per appurare uno stato patologico che per verificare l’efficacia di un trattamento antigengiviti.
Prove in vitro per valutare l'efficacia della lattoferrina
A tal fine, la placca sopra gengivale derivante da pazienti con gengivite è stata utilizzata per infettare monostrati di fibroblasti gengivali ed i risultati ottenuti sono mostrati nella tabella 3.
Dai dati riportati, appare chiaro che la sintesi di queste citochine pro-infiammatorie diminuisce in presenza di lattoferrina.
| Assenza di lattoferrina | Presenza di lattoferrina | |
|---|---|---|
| IL-6 IL-8 TNF-a | IL-6 IL-8 TNF-a | |
| Sintesi in fibroblasti non infettati | 90 2.100 22 | 90 2.100 22 |
| Sintesi in fibroblasti infettati | 90 4.100 40 | 105 1.900 29 |
con la placca sopra gengivale in presenza o in assenza di lattoferrina (60 μg/ml).
Prove in vivo per valutare l'efficacia della lattoferrina
È stata dimostrata in vivo la significativa attività antinfiammatoria della lattoferrina. In particolare, la sua somministrazione diminuisce la sintesi nel circolo di numerose citochine pro-infiammatorie inclusa l’IL-6 che fortemente influenza l’omeostasi del ferro (18).
Pertanto, al fine di dimostrare, nella cura delle gengiviti, l’efficacia di una somministrazione di una compressa orosolubile contenente 50 mg di lattoferrina 2 volte al giorno dopo accurata igiene orale, abbiamo sottoposto al trattamento, per 30 giorni, 10 volontari affetti da gengiviti e saggiato le citochine pro-infiammatorie in situ, cioé nel fluido crevicolare.
I dati delle citochine pro-infiammatorie sono stati paragonati a quelli ottenuti analizzando 10 volontari sani.
Indipendentemente dal tipo di gengiviti acute o croniche sono state prese in considerazione le concentrazione dell’IL-8, dell’IL-6 e dell’IL-1beta nel fluido crevicolare in accordo a quanto dimostrato nelle gengiviti da stress (28).
I risultati ottenuti sono riportati nella tabella 4.
| Citochine (pg/ml) | Soggetti sani | Soggetti affetti da gengiviti prima del trattamento | Soggetti affetti da gengiviti dopo 30 giorni di trattamento |
|---|---|---|---|
| IL-1 beta | 0 | 29 ± 3 | 7 ±2 |
| IL-6 | 12±5 | 45±7 | 16±6 |
| IL-8 | 32±10 | 98±12 | 44±9 |
| NF-alfa | 16 ± 5 | 28 ± 3 | 14±4 |
I dati sulla concentrazione delle citochine sono valori medi ottenuti in 10 soggetti sani e in 10 soggetti con gengiviti
prima e dopo 30 giorni di trattamento con lattoferrina.
Da quanto riportato, si può affermare che in assenza o in casi di diminuzione della concentrazione di lattoferrina e della sua efficacia dovuta a disordini dell’omeostasi ospite-microbiota, cambiamenti ormonali, completa saturazione in ferro della proteina, digestione da parte delle proteasi batteriche, l’ospite è più suscettibile alle infezioni e ai processi infiammatori patologici.
Ne consegue che la supplementazione, da 2 a 4 volte al giorno a seconda della severità dell’infezione/infiammazione gengivale, della lattoferrina (50 mg) da dissolvere nella saliva, riporta la sua concentrazione a valori fisiologici permettendo così il ripristino dell’omeostasi tra ospite e microbiota.
Al momento è l’unico composto naturale che, senza effetti avversi, svolge contemporaneamente molteplici funzioni fondamentali per la risoluzione di disordini del cavo orale di seguito descritte:
- attività antibatterica;
- attività antifungina;
- attività inibente la formazione di biofilm;
- attività inibente la formazione di specie reattive dell’ossigeno;
- attività antinfiammatoria.
- Sansonetti PJ. War and peace at mucosal surfaces.Nat Rev Immunol 2004;4:953-64.
- Lindenmüller H and Lambrecht JT. Oral care Curr Probl Dermatol 2011;40:107-15.
- Valenti P. Cavità orale: Microbiota, Saliva, Lattoferrina, Infiammazioni ed Infezioni. Doctor Os Mar 2016;27(3):303-11.
- Wilson M. Microbial Inhabitants of Humans: Their Ecology and Role in Health and Disease. Cambridge: Cambridge University Press; 2005.
- Berlutti F, Catizone A, Ricci G, Frioni A, Natalizi T, Valenti P, Polimeni A. Streptococcus mutans and Streptococcus sobrinus are able to adhere and invade human gingival fibroblast cell line. Int J Immunopathol Pharmacol 2010;23:1253-60.
- Bahrani-Mougeot FK, Paster BJ, Coleman S, Ashar J, Barbuto S, Lockhart PB. Diverse and novel oral bacterial species in blood following dental procedures. J Clin Microbiol 2008;46:2129–32.
- Lockhart PB, Brennan MT, Sasser HC, Fox PC, Paster BJ, Bahrani-Mougeot FK. Bacteremia associated with toothbrushing and dental extraction. Circulation 2008;3118–25.
- Lang NP, Schätzle MA, Löe H. Gingivitis as a risk factor in periodontal disease. J Clin Periodontol 2009; 36:3-8.
- Pihlstrom BL, Michalowicz BS, Johnson NW. Periodontal diseases. Lancet 2005;19:1809-20.
- Lopez R, Fernandez O, Jara G, Baelum V. Epidemiology of necrotizing ulcerative gingival lesions in adolescents. J Periodontal Res 2002;37:439-44.
- Holmstrup P. Necrotizing periodontal disease. In: Lindhe J, Lang NP, editors. Clinical periodontology and implant dentistry. 6th Ed. Oxford: Wiley-Blackwell; 2015.
- Mealey B, Moritz A. Hormonal influences: effects of diabetes mellitus and endogenous female sex steroid hormones on the periodontium. Periodontol 2003;32:59–81.
- Markou E, Eleana B, Lazaros T, Antonios K. The Influence of Sex Steroid hormones on Gingiva of Women. J Open Dent 2009;3:114-9.
- Groenink J, Walgreen-Weterings E, Nazmi K, Bolscher JG, Veerman EC, van Winkelhoff AJ, Nieuw Amerongen AV. Salivary lactoferrin and low-Mr mucin MG2 in Actinobacillus actinomycetemcomitans-associated periodontitis. J Clin Periodontol 1999;26(5):269-75.
- Berlutti F, Pilloni A, Pietropaoli M, Polimeni A, Valenti P. Lactoferrin and oral diseases: current status and perspective in periodontitis. Ann Stomatol 2011;2(3-4):10-8.
- Paesano R, Berlutti F, Pietropaoli M, Goolsbee W, Pacifici E, Valenti P. Lactoferrin efficacy versus ferrous sulfate in curing iron disorders in pregnant and non-pregnant women. Int J Immunopathol Pharmacol 2010a;23(2):577-87.
- Paesano R, Berlutti F, Pietropaoli M, Pantanella F, Pacifici E, Goolsbee W, Valenti P. Lactoferrin efficacy versus ferrous sulfate in curing iron deficiency and iron deficiency anemia in pregnant women. Biometals 2010b;23(3):411-7.
- Paesano R, Natalizi T, Berlutti F, Valenti P. Body iron delocalization: the serious drawback in iron disorders in both developing and developed countries. Pathog Glob Health 2012;106(4):200-16.
- Rocha DM, Zenóbio EG, Van Dyke T, Silva KS, Costa FO, Soares RV. Differential expression of salivary glycoproteins in aggressive and chronic periodontitis. J Appl Oral Sci 2012;20(2):180-5.
- Papacosta E, Nassis GP. Saliva as a tool for monitoring steroid, peptide and immune markers in sport and exercise science. J Sci Med Sport 2011;14:424-34.
- Friedman SA, Mandel ID, Herrera MS. Lysozyme and lactoferrin quantitation in the crevicular fluid. J Periodontol 1983;54:347-50.
- Suomalainen K, Saxen L, Vilja P, Tenovuo J. Peroxidases, lactoferrin and lysozyme in peripheral blood neutrophils, gingival crevicular fluid and whole saliva of patients with localized juvenile periodontitis. Oral Dis 1996;2:129-34.
- Jentsch H, Sievert Y, Göcke R. Lactoferrin and other markers from gingival crevicular fluid and saliva before and after periodontal treatment. J Clin Periodontol 2004;31:511-4.
- Eberhard J, Drosos Z, Tiemann M, Jepsen S, Schröder JM. Immunolocalization of lactoferrin in healthy and inflamed gingival tissues. J Periodontol 2006;77:472-8.
- Wei PF, Ho KY, Ho YP, Wu YM, Yang YH, Tsai CC. The investigation of glutathione peroxidase, lactoferrin, myeloperoxidase and interleukin-1b in gingival crevicular fluid: implications for oxidative stress in human periodontal diseases. J Periodontal Res 2004;39:287-93.
- Ambatipudi KS, Lu B, Hagen FK, Melvin JE, Yates JR. Quantitative analysis of age specific variation in the abundance of human female parotid salivary proteins. J Proteome Res 2009;8:5093-102.
- Ozdemir B, Ozcan G, Karaduman B, Teoman AI, Ayhan E, Ozer N, Us D. Lactoferrin in gingival crevicular fluid and peripheral blood during experimental gingivitis. Eur J Dent 2009;3:16-23.
- Weik U, Herforth A, Kolb-Bachofen V, Deinzer R. Acute stress induces proinflammatory signaling at chronic inflammation sites. Psychosom Med 2008; 70:906-12.