Il granuloma piogenico (PG) è un esempio di iperplasia infiammatoria che può presentarsi a livello del cavo orale (1) e rappresenta la più comune lesione proliferativa (2). Il termine iperplasia infiammatoria include anche altre lesioni come l’iperplasia infiammatoria fibrosa, l’iperplasia papillare palatale, il granuloma a cellule giganti e l’epulide gravidica (3). Clinicamente il granuloma piogenico orale si presenta come una massa morbida, liscia o lobulata, non dolente, sessile o peduncolata con crescita esofitica; il colore varia dal rosa al rossastro e possono presentarsi fenomeni emorragici spontanei o indotti dopo un trauma minore (4, 5).
Ne fu riportato il primo caso nella letteratura inglese da Hullihen SP nel 1844; il PG venne successivamente descritto nel 1897 da due chirurghi francesi, Poncet e Dor, che chiamarono questa lesione “botryomycosis hominis” (6). In seguito numerosi nomi vennero dati alla lesione come “granuloma pediculatum benignum”, “benign vascular tumor”, “pregnancy tumor”, “vascular epulis”, “Crocker and Hartzell’s disease”. Il nome attuale gli venne attribuito da Crocker nel 1903; tuttavia, alcuni ricercatori credono che fu Hartzell MB nel 1904 ad introdurre il termine di “pyogenic granuloma”. Quest’ultimo, però, è improprio poiché esso non è ne correlato ad un’infezione, ne contiene pus, ne è un vero granuloma; l’esatta eziopatogenesi rimane sconosciuta, sebbene risultino essere coinvolti fattori come il trauma, l’infiammazione ed agenti infettivi (7). Angelopoulos AP propose la dizione di “hemangiomatous granuloma” che esprime in maniera accurata l’aspetto istopatologico e la natura infiammatoria del PG. Cawson e collaboratori hanno suggerito il termine di “granuloma telangiectacticum” data la numerosità dei vasi sanguigni presenti al livello della lesione (2).
Sebbene il PG sia una comune patologia della pelle, esso è estremamente raro nel tratto gastrointestinale, ad eccezione del cavo orale dove spesso si localizza sul tessuto cheratinizzato (3). Nel 75% dei casi, infatti, esso si sviluppa sulla gengiva cheratinizzata, nei restanti casi, invece, a livello delle labbra, della lingua, della mucosa buccale e del palato (1); inoltre è più comune a livello della gengiva del mascellare rispetto alla gengiva della mandibola, con una maggior prevalenza nei settori anteriori rispetto a quelli posteriori (8).
Si evidenziano due profili istopatologici del PG chiamati rispettivamente emangioma capillare lobulare (LCH) e non-LCH (4). Il trattamento d’elezione è di tipo chirurgico con rimozione del fattore causale (5).
EOIDEMIOLOGIA
Bhaskar e collaboratori hanno osservato che il granuloma piogenico rappresenta l’1,85 % di tutte le patologie orali (2, 9); Esmeili e collaboratori nella loro revisione affermano che le lesioni iperplastiche reattive rappresentano il gruppo di lesioni più comuni dopo la carie, la malattia parodontale ed i disturbi infiammatori periapicali (2, 10). Sebbene il granuloma piogeno possa manifestarsi a tutte le età, esso è più frequente nella seconda decade di vita (con un range che spazia dai 4,5 ai 93 anni; 2) e nelle donne, probabilmente a causa degli effetti vascolari degli ormoni femminili; esso infatti si sviluppa in circa il 5% delle donne gravide da qui il termine di “pregnancy tumor” e “ granuloma gravidarum” (3). Secondo Enric Jané-Salas e collaboratori, invece, sembra esserci una maggior prevalenza nell’uomo quando il granuloma piogenico si trova in associazione ad impianti dentari (8).
EZIOPATOGENESI
Staphylococci, botryomiceti, corpi estranei ed infezioni localizzate a livello delle pareti vascolari sono state identificati da Kerr nel 1951 come fattori in grado di portare allo sviluppo del PG (2, 11). Bhaskar e collaboratori nel 1966 hanno dimostrato la presenza di ceppi batterici di bacilli Gram positivi e Gram negativi nel granuloma piogenico orale, descrivendo però che questi organismi erano più comuni nelle lesioni ulcerate e suggerendo che rappresentavano dei contaminanti provenienti dalla flora orale (2, 9). Attualmente si ritiene che il PG si sviluppi come risultato di un trauma minore dei tessuti proveniente dall’invasione di un tipo di microrganismi non specifico; questo tessuto risponde in maniera caratteristica nei confronti di quelle specie microbiche con bassa virulenza sviluppando una risposta proliferativa sproporzionata del tessuto connettivo di tipo vascolare, ciò secondo il principio biologico che afferma che ogni irritante applicato ad un tessuto vivente può agire o da agente stimolante o da agente distruttivo, o da entrambi (2). Altri fattori eziologici possono essere rappresentati da trauma, lesioni a denti da latte, irritazione cronica, disordini ormonali, farmaci (le ciclosporine ad esempio sembrano avere un ruolo importante nella genesi del PG; 3), infiammazioni gengivali, preesistenti lesioni vascolari, lesioni croniche causate dell’esfoliazione dei denti da latte, eruzione dei denti permanenti, restauri debordanti nella regione della lesione, trauma causato dal cibo, parodontiti, trauma da spazzolamento, neoplasie, patologie sistemiche come leucemie, la granulomatosi di Wegener… (2, 12).
Nel 1997 Murata e collaboratori hanno osservato che dopo ogni trauma si ha la guarigione della ferita tramite la formazione del tessuto di granulazione e ciò include la migrazione delle cellule infiammatorie, la migrazione e la proliferazione di cellule vascolari endoteliali e di fibroblasti e la sintesi di matrice extracellulare; questi processi di guarigione sembrano essere controllati da vari tipi di citochine. Nel loro studio essi hanno evidenziato il ruolo dei fattori di crescita nella gengiva e nel PG nei suoi vari stadi di progressione, in particolare hanno descritto l’immunolocalizzazione del bFGF un “heparin binding angiogenic protein” con un alto potenziale mitogenico sulle cellule capillari endoteliali in grado di indurre angiogenesi. Loro hanno suggerito che la massima quantità di bFGF è sintetizzata e rilasciata da alcuni macrofagi e mastociti all’interno della matrice extracellulare durante la neo-vascolarizzazione del tessuto di granulazione (2, 13, 14). Altri studi osservano l’incremento dei mastociti nel tessuto connettivo del granuloma piogenico (14).
Altri fattori come l’ossido nitrico sintetasi inducibile, il fattore di crescita vascolare endoteliale, il fattore di crescita basico dei fibroblasti o il fattore di crescita del tessuto connettivo sembrano essere coinvolti nell’angiogenesi e rapida crescita del PG (3). Hosseini e collaboratori hanno osservato che la gengiva si può accrescere durante la gravidanza e può atrofizzarsi durante la menopausa; sulla base di ciò essa può rappresentare un organo target dell’azione diretta degli estrogeni e del progesterone (2, 15). Il profondo disequilibrio endocrino che si ha durante la gravidanza sembra essere infatti frequentemente associato con cambiamenti nella funzione e struttura dei vasi ed il circolo microvascolare linfatico della pelle e della mucosa (3, 16). Studi recenti rivelano che gli ormoni sessuali hanno vari effetti biologici ed immunologici; gli estrogeni accelerano la guarigione della ferita stimolando il Nerve Growth Factor (NGF) prodotto nei macrofagi, il Granulocyte-Macrophage-Colony Stimulating Factor (GM-CSF) prodotto nei cheratinociti ed il basic Fibroblast Growth Factor (bFGF) ed il Transforming Growth Factor Beta1 (TGF-β1) prodotto nei fibroblasti, portando alla formazione del tessuto di granulazione. Gli estrogeni aumentano il Vascular Endothelial Growth Factor (VEGF) prodotto nei macrofagi, effetto che è antagonizzato dagli androgeni e che può essere connesso con lo sviluppo del PG durante la gravidanza. Al termine della gravidanza il granuloma piogenico può regredire spontaneamente, ma il meccanismo non è ancora stato chiarito; vengono indagate molecole come l’angiopoietina2 ed il Tumor Necrosis Factor-a (TNF-a) (3).
ISTOPATOLOGIA
La superficie della lesione può subire cambiamenti secondari, aspecifici, che includono edema stromale, dilatazione capillare, infiammazione e reazione con tessuto di granulazione (17). La superficie è generalmente ulcerata e ricoperta da una fine membrana fibrino-purulenta (18); un infiltrato di neutrofili è prevalente vicino alla superficie ulcerata, cellule caratteristiche dell’infiammazione cronica si trovano più a fondo. La storia naturale della lesione segue tre fasi distinte: nella fase cellulare, i lobuli sono compatti e presentano un piccolo lume; nella fase capillare essi diventano francamente vascolari con abbondanti globuli rossi intraluminari, uno o più vasi centrali sviluppano un lume largo con un fine strato muscolare ricordando la struttura venosa; nella fase involutiva c’è la tendenza alla fibrosi intra e perilobulare con l’incremento della differenziazione lobulare (3, 19).
Ci sono due tipi istopatologici del PG. Il primo tipo è caratterizzato da una proliferazione dei vasi sanguigni che si organizzano in aggregati lobulari, sebbene superficialmente la lesione non mostra cambiamenti specifici, incluso edema, dilatazione capillare o reazione con tessuto infiammatorio: questo tipo istologico viene chiamato emangioma capillare lobulare (LCH type). Il secondo tipo (non-LCH type) è rappresentato invece da un’alta proliferazione vascolare che assomiglia al tessuto di granulazione. L’area lobulare del granuloma piogenico LCH contiene un gran numero di vasi sanguigni dal piccolo diametro luminale così come accade nell’area centrale del non-LCH PG (3).
CARATTERISTICHE CLINICHE
Clinicamente il granuloma piogenico è una lesione esofitica liscia o lobulata che si manifesta come papule eritematose rosse e piccole su di una base a volte sessile a volte peduncolata; esso è generalmente emorragico e comprimibile (3). Epivatianos e collaboratori hanno osservato che il PG LCH si manifesta più frequentemente (66%) come una lesione semplice, mentre il PG non-LCH risulta essere generalmente peduncolato (77%) (20). Il diametro della lesione varia da pochi millimetri a diversi centimetri, raramente supera i 2,5 cm e generalmente raggiunge la sua grandezza massima in settimane o mesi, rimanendo poi inalterato (2, 14). Il decorso clinico della lesione è lento, sintomatico e indolore ma a volte può avere una rapida crescita. La superficie può essere ulcerata e friabile e può essere coperta da una membrana giallo-fibrinosa; il colore del PG può variare dal rosso fucsia al rosa, a seconda dell’età della lesione. Le lesioni appena formatesi sono altamente vascolari poiché sono composte in gran parte da tessuto di granulazione iperplastico, pertanto il colore tende maggiormente al rossastro; anche traumi minori sulla lesione possono condurre ad un sanguinamento considerevole. Le vecchie lesioni, invece, tendono ad essere più ricche in collagene e tendono ad avere un colore più rosato (3).
Non vi sono riscontri radiologici del granuloma piogeno, sebbene in rari casi è stato osservato un riassorbimento localizzato dell’osso alveolare (2). Soltanto utilizzando una tomografia computerizzata è possibile osservare questa iperplasia dei tessuti molli, sebbene essa non rappresenti un esame utilizzato per la diagnosi. Gli esami radiografici possono essere tuttavia importanti per escludere rilevanti perdite di osso a causa ad esempio di neoplasie o per identificare eventuali corpi estranei (7).
DIAGNOSI DIFFERENZIALE
La diagnosi di PG viene fatta attraverso una biopsia escissionale della lesione (3). Il PG entra in diagnosi differenziale con il granuloma periferico a cellule giganti (PGCG), il fibroma periferico ossificante, il fibroma, il fibroma periferico odontogeno, l’emangioma, il tessuto di granulazione convenzionale, l’infiammazione gengivale iperplastica, il sarcoma di Kaposi, l’angiomatosi bacillare, l’angiosarcoma, il linfoma non-Hodgkin e i tumori metastatici (2, 3, 22).
Il PGCG è una lesione esofitica che si riscontra esclusivamente a livello della gengiva ed è clinicamente simile al PG, anche se è spesso di un colore più bluastro (3). Il fibroma ossificante o il fibroma odontogeno periferico si hanno esclusivamente a livello della gengiva; tali lesioni hanno una limitata componente vascolare e possono entrare in diagnosi differenziale con un granuloma piogenico di non recente formazione. Il PG può inoltre entrare in diagnosi differenziale con l’emangioma data la ricca vascolarizzazione; la distinzione può essere effettuata solo istologicamente, infatti l’emangioma mostra una proliferazione delle cellule endoteliali senza l’infiltrato cellulare dell’infiammazione acuta che invece è presente nel PG (3, 22). Sebbene i tumori metastatici nel cavo orale siano poco comuni, la gengiva aderente è il tessuto molle più coinvolto, seguito dalla lingua. Nel 30% dei casi, la metastasi orale è la prima indicazione di una neoplasia a distanza non ancora diagnosticata (3). Il sarcoma di Kaposi da AIDS mostra una proliferazione di cellule fusate displasiche, spazi vascolari dilatati, stravaso di globuli rossi e globuli ialini intracellulari, aspetti non presenti non PG; la diagnosi differenziale di sarcoma di Kaposi richiede una valutazione microscopica del materiale bioptico poiché esso può mimare un ampio numero di lesioni orali come il PG. Il linfoma non-Hodgkin (NHL) può avere manifestazioni orali simili al PG; i siti primari della testa e del collo sono l’anello di Waldeyer, i seni paranasali, le ghiandole salivari, la cavità orale ed il laringe. Le manifestazioni cliniche dell’NHL gengivale sono varie ma generalmente sono rappresentate da una proliferazione gengivale asintomatica o una massa che ricorda il PG (3).
TRATTAMENTO
L’escissione chirurgica è il trattamento d’elezione per il PG; è raccomandato anche un attento curettage dei tessuti circostanti. I margini dell’escissione devono essere di almeno 2 mm (2); sebbene un’escissione chirurgica conservativa ed una rimozione degli irritanti causali (placca, tartaro, corpi estranei, fonti di trauma) sono la terapia usuale, l’escissione deve estendersi fino al periostio e i denti adiacenti dovrebbero essere attentamente curettati per rimuovere ogni forma di irritazione cronica (3). Mandatorio è l’esame istologico che permette una diagnosi definitiva.
Altri protocolli di trattamento sono stati proposti; Powell e collaboratori hanno descritto l’utilizzo del laser dato il minor rischio di sanguinamento rispetto alle altre tecniche chirurgiche (3, 23). Ishida e Ramos-e-Silva ritengono che la criochirurgia sia una tecnica utile nel trattamento del PG poiché la mucosa orale rappresenta un sito ideale per questa tecnica (3, 24). Sebbene la terapia chirurgica sia la più utilizzata, frequentemente essa può esitare in cicatrici (3, 25). La scleroterapia tramite l’iniezione di etanolo assoluto, tetradilsolfato di sodio e corticosteroidi è stata anche proposta come terapia ottenendo risultati di successo in caso di lesioni recidivanti (7). Il tasso di recidiva del PG è di circa il 16% ed una rescissione della lesione potrebbe essere necessaria (2, 3, 5, 7, 12).
Considerazioni sul trattamento durante la gravidanza sono molto importanti, sono infatti comuni recidive durante questo periodo (2) ed inoltre è possibile una riduzione del volume della lesione dopo il parto rendendo la chirurgia non necessaria (3).
Numerosi sono i casi clinici precedentemente descritti in letteratura (5, 6, 7, 12, 22, 26-34). Di seguito viene riportato un caso clinico esplicativo al fine di chiarire gli aspetti pratici.
PRESENTAZIONE DEL CASO
Donna di 46 anni si è presentata con una evidente tumefazione a livello della gengiva cheratinizzata della cresta alveolare in corrispondenza dell’elemento 2.7. La lesione era di consistenza duro elastica, superficie irregolare e colorito marcatamente rossastro; la crescita era sintomatica. La storia medica del paziente non mostrava nessuna patologia riconducibile alla lesione. Il paziente riferiva discomfort con sanguinamento della lesione durante la masticazione. Dall’esame clinico e radiografico è emersa la presenza del residuo radicolare dell’elemento 2.7 con concomitante trauma occlusale in prossimità del tessuto iperplastico; inoltre era presente una condizione di scarsa igiene orale riconducibile sia alla presenza di placca che all’elevato numero di restauri conservativi (figg. 1A e 1B).
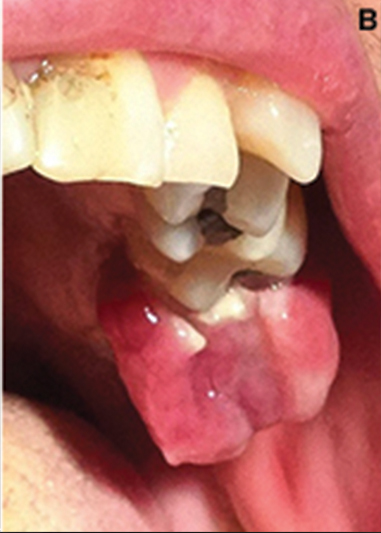
della lesione iperplastica.
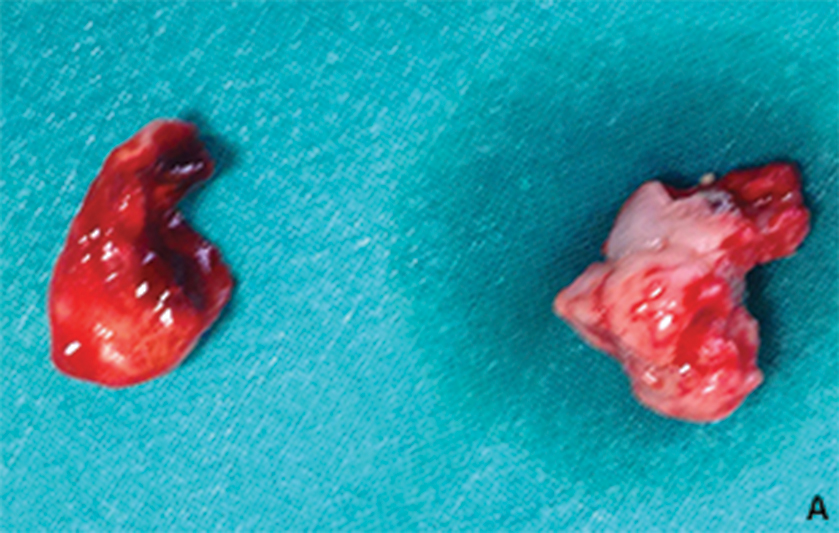
È stata quindi ipotizzata una diagnosi di granuloma piogenico ed effettuata estrazione del residuo radicolare del 2.7 con biopsia escissionale della lesione in anestesia locale utilizzando mepivacaina con adrenalina, che ha confermato il sospetto diagnostico (figg. 2A).
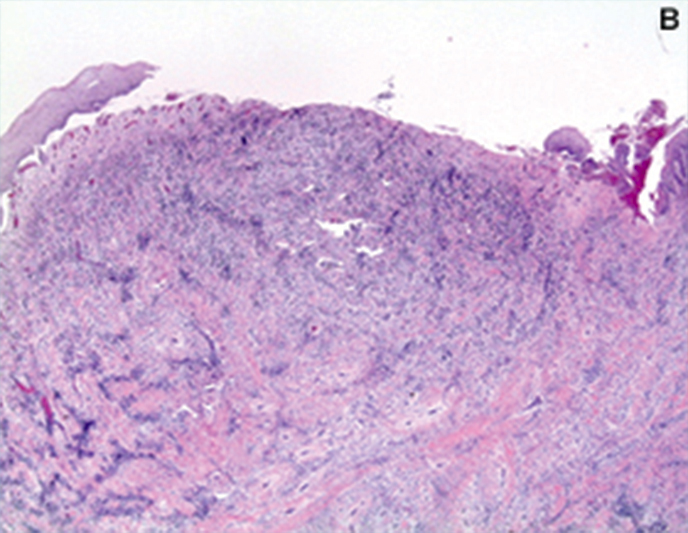
L’esame istopatologico eseguito utilizzando il colorante ematossilina eosina ha rivelato la presenza di masse lobulari di tessuto di granulazione iperplasico con un epitelio squamoso stratificato con segni di iperplasia ed ipercheratinizzazione. Il sottostante tessuto connettivo mostrava un’accentuata proliferazione di cellule endoteliali e fibroblasti; evidente la neo-vascolarizzazione ed un infiltrato di cellule infiammatorie come linfociti, plasmacellule e neutrofili. È stata quindi confermata la diagnosi di granuloma piogenico (figg. 2B e 2C).
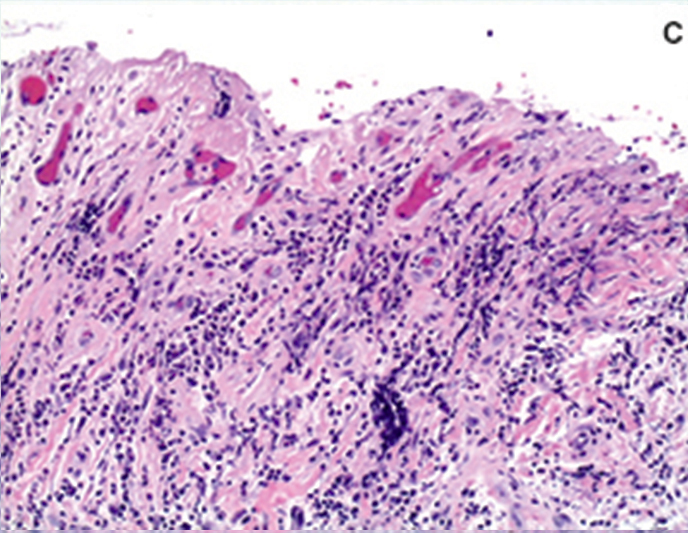
CONCLUSIONI
Nel cavo orale il granuloma piogenico mostra una marcata predilezione per la gengiva della papilla interdentale; quest’ultimo rappresenta il sito più comune, infatti è colpito nel 70% dei casi. Molti studi dimostrano che la prevalenza della lesione ha un rapporto di due a uno spostato verso le donne. Diversi possono essere i fattori causali tra cui trauma occlusale in quell’area, presenza di placca, tartaro, restauri debordanti e fattori ormonali. La diagnosi viene condotta tramite esame istologico che evidenzia la natura infiammatoria della lesione. L’escissione chirurgica è il trattamento d’elezione per il granuloma piogenico, che può però recidivare. ●
- Al-Shamiri HM, Alaizari NA, Al-Maweri SA, Tarakji B. Development of pyogenic granuloma and hemangioma after placement of dental implants: A review of literature. J Int Soc Prev Community Dent 2015;5(2):77-80.
- Kamal R, Dahiya P, Puri A. Oral pyogenic granuloma: various concepts of etiopathogenesis. J Oral Maxillofac Pathol 2012; 16(1):79-82.
- Hamid J, Majid S, Nooshin M. Oral pyogenic granuloma: a review. Journal of Oral Science 2006;48(4):167-75.
- Epivatianos A, Antioniades D, Zaraboukas T, Zairi E, Puolopuolos A, Kiziridou A, Iordanidis S. Pyogeic Granuloma of the oral cavity: Comparative study of its clinicopathological and immunohistochemical features. Pathology international 2005;55:391-7.
- Manjunath N, George RS, Sabhachandani N. Pyogenic Granuloma: An extragingival hyperplastic lesion. A case report. IOSR Journal of Dental and Medical Sciences 2014;13(12):14-6.
- Deshmukh J, Kulkarni VK, Katti G, Deshpande S. Pyogenic Granuloma, An Unusual Presentation In Pediatric Patient- A Case Report. Indian Journal of Dental Sciences 2013;5(1):90-3.
- Kurian B, Sasirekhan, Ebenezer. Pyogenic Granuloma – a Case Report and Review. International Journal of Dental Sciences and Research 2014;2(3):66-8.
- Jané-Salas E, Albuquerque R, Font-Muñoz A, Gonzàlez-Navarro B, Estrugo Devesa A, Lòpez-Lopez J. Pyogenic Granuloma/Peripheral Giant-Cell Granuloma Associated with Implants. International Journal of Dentistry 2015;1-9.
- Bhaskar SN, Jacoway JR. Pyogenic granuloma – clinical features, incidence, histology, and result of treatment: Report of 242 cases. J Oral Surg 1966;24: 391-8.
- Esmeili T, Lozada-Nur F, Epstein J. Common benign oral soft tissue masses. Dent Clin North Am 2005; 49:223-40.
- Kerr DA. Granuloma Pyogenicum. Oral Surg 1951;4:158.
- Kejriwal S, Bhandary R, Thomas B. Oral pyogenic granuloma: a case report. NUJHAS 2014;4(1):123-5.
- Murata M, Hara K, Saku T. Dynamic distribution of basic fibroblast growth factor during epulis formation: An immunohistochemical study in an anhanced healing process of the gingiva. J Oral Pathol Med 1997;26:224-32.
- Kamal R, Dahiya P, Goyal N, Kumar M, Sharma N, Saini H.R. Mast cells and oral pathologies: A review. J Nat Sci Biol Med 2015;6(1):35-9.
- Hosseini FH, Tirgari F, Shaigan S. Immunohistochemical analysis of estrogen and progesterone receptor expression in gingival lesions. Iran J Public Health 2006;35:38-41.
- Henry F, Quatresooz P, Valverde-Lopez J.C, Pierard G.E. Blood vessel changes during pregnancy: a review. Am J Clin Dermatol 2006;7:65-9.
- Willies-Jacobo LJ, Isaacs H, Stein MT. Pyogenic granuloma presenting as a congenital epulis. Arch Pediatr Adolesc Med 2000;154:603-5.
- Neville BW, Damm DD, Allen CM, Bouquot JE. Oral & maxillofacial pathology. 2nd ed. Philadelphia: WB Saunders; 2002. p. 437-95.
- Stenberg SS, Antonioli DA, Carter D, Mills SE, Oberman H. Diagnostic surgical pathology. 3rd ed, Philadelphia: Lippincott Williams & Wilkins; 1999. p. 69-174.
- Epivatianos A, Antoniades D, Zaraboukas T, Zairi E, Poulopoulos A, Kiziridou A, Iordanidis S. Pyogenic granuloma of the oral cavity: comparative study of its clinicopathological and immunohistochemical features. Pathol Int 2005;55:391-7.
- Ainamo J. The effect of habitual tooth cleaning on the occurrence of periodontal disease and dental caries. Suom Hammaslaak Toim 1971;67:63.
- Gangwar V, Singal D, Naik S, Anshul, Arora S. Pyogenic granuloma. JDSOR 2014;5(2):111-3.
- Powell JL, Bailey CL, Coopland AT, Otis CN, Frank JL, Meyr I. Nd: YAG laser excision of a giant ginigival pyogenic granuloma of pregnancy. Lasers Surg Med 1994;14:178-83.
- Ishida CE, Ramos-E-Silva M. Cryosurgery in oral lesion. Int J Dermatol 1998;37:283-5.
- Abdulai AE, Nuamah IK, Baddoo H, Gyasi RK. Oral pyogenic granuloma in Ghanaians: a review of cases. Int J Med Biomed Res 2013;2(3):173-8.
- Mubeen K, Vijayalakshmi KR, Abhishek RP. Oral pyogenic granuloma with mandible involvement: An unusual presentation. Journal of Dentistry and Oral Hygiene 2011;3(1):6-9.
- Gotmare S, Tamgadge AP, Bhalerao SS, Pereira T, Tamgadge S. Pyogenic granuloma – a case report. Scientific Journal 2009; vol. III.
- Reddy V, Saxena S, Saxena S, Reddy M. Reactive hyperplastic lesions of the oral cavity: A ten year observational study on North Indian Population. J Clin Exp Dent 2012;4(3):136-40.
- Verma P.K, Srivastava R, Baranwal H.C, Chaturvedi T.P, Gautam A, Singh A. Pyogenic Granuloma – Hyperplastic Lesion of the Ginigiva: Case Reports. The Open Dentistry Journal 2012;6:153-6.
- Vaidya S, Kapoor C, Ohri N, Singh HP. Pyogenic granuloma: A diagnostic dilemma. IJMDS 2013;2(1):88-93.
- Kuyama K, Kenji F, Ochiai E, Wakami M, Oomine H, Sun Y, Morikawa M, Iwadate K, Yamamoto H. Pyogenic granuloma associated with Actinomyces israelii. Journal of Dental Sciences 2013;20:1-4.
- Baratli J, Holzle F, Megahed M. Granuloma pyogenicum der Mundschleimhaut. Hautarzt 2014; 65:388-9.
- Bumb SS, Chandra S, Jain A, Singh I. Pyogenic Granuloma – A Gingival Menace. International Journal of Advanced Health Sciences 2014;1(1):21-4.
- Venugopal S, Shobha KS, Netravathi TD. Pyogenic granuloma – A case report. Journal of Dental Sciences & Research;1(1):80-5.





