La parodontite è la sesta malattia cronica non trasmissibile più diffusa al mondo ed è ancora la causa principale di perdita dentale nella popolazione, generando un importante impatto sia sanitario che socio-economico (1).
La malattia parodontale deve essere interpretata come la progressione di uno stato infiammatorio cronico in cui una perturbazione dell’omeostasi tra ospite e batteri, in soggetti suscettibili, porta alla distruzione dei tessuti profondi in maniera irreversibile.
Circa il 60% della popolazione italiana è affetta da parodontite con un picco di incidenza a 38 anni, di questi il 10-14 % è ammalata di una forma grave (2). Oggi sappiamo che può rappresentare un potenziale fattore di rischio per alcune patologie sistemiche, quali batteriemie, endocarditi acute e subacute, patologie cardiovascolari, ipertensione arteriosa, infezioni di protesi sostitutive, diabete, malattie respiratorie; è correlata al rischio di nascita di bambini pretermine e sottopeso e può essere alla base di fenomeni ascessuali cerebrali e di altre patologie “focali”.
Queste conoscenze sottolineano l’inderogabile necessità di diagnosticare precocemente la parodontite per instaurare le corrette procedure preventive e terapeutiche. Una quota rilevante di queste patologie non viene attualmente diagnosticata, né adeguatamente trattata e la mancata diagnosi e il trattamento precoci influenzano grandemente la progressiva distruzione dell’apparato di sostegno dei denti, con conseguente compromissione della funzione masticatoria e dell’aspetto estetico. La prevalenza delle forme moderate e gravi non è sostanzialmente cambiata nonostante ci sia stata un’evoluzione della parodontologia intesa come migliore comprensione degli eventi biologici che stanno alla base delle patologie gengivali. Il carattere epidemico di questa infezione, che ha così poco modificato la sua incidenza nell’ultimo trentennio, dovrebbe seriamente far riflettere ogni clinico sui motivi per cui questo cambiamento non sia ancora avvenuto e le motivazioni potrebbero risiedere sì nella complessità biologica della malattia ma anche nella presenza di determinanti psico-sociali spesso difficilmente modificabili. In seguito al Workshop mondiale del 2017 la Federazione europea di parodontologia (EFP) ha introdotto una nuova classificazione della malattia parodontale che mira a collegare l’approccio alla prevenzione e al trattamento, in quanto descrive non solo la gravità e l’estensione della malattia, ma anche il grado di complessità e il rischio per l’individuo (3). La malattia parodontale, pertanto, può essere classificata a seconda del grado di severità, di complessità, di distruzione e di rapidità di progressione. La classificazione prevede 4 stadi e 3 gradi e l’estensione della malattia può essere distinta tra generalizzata e localizzata. Nel 2020 sono state quindi pubblicate le linee guida a disposizione del clinico per il trattamento degli stadi I-III (4), seguite successivamente nel 2022 dalle linee guida per il trattamento degli stadi IV (5). Si è sentita pertanto la necessità di produrre e implementare linee guida cliniche che forniscano raccomandazioni per il trattamento della parodontite al fine di garantire un razionale iter terapeutico per i pazienti e assicurare l’appropriatezza degli interventi preventivi e terapeutici al variare dello stadio e del grado della malattia (6). La scelta di questi interventi deve essere fatta seguendo un rigoroso processo decisionale basato sull’evidenza scientifica. Una volta diagnosticata la malattia parodontale, il paziente dovrebbe essere trattato con un approccio graduale prestabilito che include diversi interventi (step 1,2,3). Un prerequisito essenziale è quello di informare il paziente rispetto alla diagnosi, alle cause della malattia, ai fattori di rischio, alle alternative terapeutiche, ai rischi e ai benefici attesi anche nel caso in cui non venga intrapreso il trattamento. Il piano di cure personalizzato per ogni paziente può essere modificato durante il percorso, tenendo conto delle preferenze del paziente, dei risultati clinici e delle modifiche della salute generale. Ma veniamo alla descrizione di quanto contenuto nelle linee guida: lo scopo dello step 1 è quello di guidare il cambiamento nelle abitudini e nello stile di vita, motivando il paziente a intraprendere con successo il controllo del biofilm sopragengivale e dei fattori di rischio. Ad oggi è ampiamente dimostrato come la rimozione meccanica del biofilm sia l’obiettivo primario per rendere efficace la terapia parodontale. Pertanto, le istruzioni di igiene orale (oral hygiene instruction, OHI) e la capacità nel gestire il biofilm in ambito domiciliare sono la chiave per il successo della salute gengivale ed è compito del professionista istruire correttamente e in maniera personalizzata il paziente (7). Sono altresì importanti le manovre professionali per rimuovere placca e tartaro sopragengivale (professional mechanical plaque removal, PMPR) ed eliminare i fattori ritentivi di biofilm che possono rendere difficili le manovre di igiene domiciliare. Considerando il mantenimento dentale come end-point reale della terapia e riferendoci di conseguenza a risultati nel lungo termine, il miglioramento dell’igiene orale dei pazienti e la loro regolare frequenza nei programmi di terapia di supporto si sono dimostrati i più importanti fattori prognostici positivi (8). Durante lo step 1 il professionista si impegnerà ad eliminare, per quanto possibile, o a modificare i fattori di rischio sistemici, locali e comportamentali che giocano un ruolo importante nell’esordio e nella progressione della malattia parodontale, come l’abitudine al fumo, l’alterazione metabolica del diabete, la scarsa attività fisica, attraverso il counseling e il colloquio motivazionale. Laddove necessario il clinico potrà indirizzare il paziente verso specialisti di altre discipline mediche (diabetologo, medico di base, cardiologo, internista, nutrizionista, ginecologo, ecc.). Lo step 1 della terapia dovrebbe essere applicato ad ogni paziente con parodontite, indipendentemente dallo stadio e dal grado ed è necessario continuare a costruire la motivazione e l’aderenza alla terapia, implementando le abilità tecniche del paziente nella rimozione del biofilm e consentendo la risposta appropriata nelle successive fasi della terapia (step 2 e step 3).
Lo scopo dello step 2 è quello di rimuovere i depositi di biofilm e tartaro sottogengivali attraverso un intervento professionale (active periodontal therapy, APT): questa seconda fase terapeutica deve essere proposta a tutti i pazienti affetti da parodontite, indipendentemente dalla gravità della malattia, lavorando solo su quei denti che hanno perso supporto parodontale e presentano tasche parodontali attive. L’APT ha la finalità di creare un ambiente dento-gengivale che permetta la guarigione dei tessuti parodontali e la possibilità di conservare i denti colpiti dalla malattia nel lungo termine. La terapia parodontale non chirurgica ha una lunga storia ed è stata tradizionalmente eseguita utilizzando una varietà di strumenti, manuali e meccanici, con l’obiettivo di decontaminare le superfici radicolari rimuovendo la placca batterica, il tartaro e il cemento radicolare contaminato. Tuttavia, già dagli anni Trenta, è diventato evidente come il deposito di tartaro non causi la malattia ma ne sia conseguenza, che il cemento non diventi significativamente infetto e che i batteri e le loro tossine siano solo blandamente aderenti alla superficie della radice. Questo ha portato allo sviluppo di strumenti e tecniche di trattamento meno invasive al fine di migliorare i risultati clinici e ridurre il disagio per il paziente (9). Lo scaling e root planing (SC/RP) sono stati e sono ancora considerati il gold standard del trattamento non chirurgico del paziente affetto da malattia parodontale. All’inizio degli anni Ottanta i dubbi sollevati rispetto al fatto che le endotossine batteriche riuscissero a penetrare all’interno del cemento radicolare hanno portato a rivalutare la necessità di eseguire un trattamento invasivo che comportasse la perdita significativa di tessuto duro dentale (14). Queste nuove conoscenze hanno permesso di introdurre una nuova modalità nel trattamento non chirurgico definibile con il termine di periodontal debridement o root surfaces debridement (RSD) come alternativa allo SC/RP, al fine di raggiungere una superficie radicolare decontaminata e compatibile con la guarigione dei tessuti parodontali senza però rimuovere struttura dentale (10).
Il Mesh database, infatti, definisce il periodontal debridement come “la rimozione o distruzione dei depositi di biofilm e tartaro senza rimuovere deliberatamente il cemento radicolare, come avviene invece nella procedura di SC/RP”: oltre ad avere il vantaggio di essere una metodica più conservativa, richiede un tempo di trattamento minore e fornisce un maggior comfort per il paziente (11). Il concetto del RSD non è però strumento-dipendente, infatti la decontaminazione con un approccio minimamente invasivo può essere ottenuta con qualsiasi mezzo, sia meccanico che manuale.
Risulta determinante la filosofia sposata dall’operatore nel rendere la procedura non chirurgica più o meno invasiva. Inoltre, come ribadito dalle nuove linee guida, i risultati ottenibili con la strumentazione sottogengivale sono equivalenti nel caso vengano impiegati singolarmente strumenti manuali, meccanici (sonici e ultrasonici) oppure la combinazione di entrambi. Anche la superiorità di un approccio rispetto ad un altro non è dimostrabile; il trattamento parodontale non chirurgico a quadranti e quello “a tutta bocca” possono essere applicati al paziente durante lo step 2 ottenendo i medesimi risultati.
La scelta della tipologia di seduta deve pertanto tenere conto delle esigenze del paziente e del clinico, sebbene l’esecuzione del trattamento in un’unica soluzione risulti essere la modalità di lavoro più efficiente in quanto richiede un tempo minore alla poltrona (12).
Sappiamo però che un approccio non chirurgico intensivo come quello full mouth potrebbe non essere prudente per pazienti in politerapia e con comorbilità mediche in quanto nelle 24h successive alla procedura potrebbe generarsi un aumento di marker infiammatori (13). Quando si parla di risultati della terapia parodontale non chirurgica oggi facciamo riferimento all’outcome primario di “percentuale di chiusura della tasca” inteso come vero obiettivo delle nostre terapie, considerando come tasca chiusa quella con una profondità di sondaggio ≤ 4mm senza sanguinamento. Rimane comunque interessante analizzare i parametri surrogati come la riduzione del PD (periodontal depth) e il miglioramento del CAL (clinical attachment level). Dalla revisione sistematica di Suvan del 2020 apprendiamo che la terapia parodontale non chirurgica ottenuta con una modalità convenzionale (ovvero con strumentazione manuale e meccanica ma senza aver adottato una filosofia mininvasiva) è in grado di ottenere il 57% di chiusura della tasca e una riduzione di PD di 1.0 mm a 3/4 mesi arrivando al 74% e a 1,7mm dopo 6/8 mesi (14). Le tasche più profonde (> 7mm) hanno una riduzione di PD media più alta (2,6mm) rispetto a quelle meno profonde (1,5mm).
Dalle pubblicazioni del professor Tomasi con approccio multilivello, comprendiamo come la probabilità di chiusura della tasca sia notevolmente influenzata da fattori legati al dente, come la profondità di sondaggio iniziale e l’anatomia radicolare, e da fattori legati al paziente come l’età, la presenza di placca e l’abitudine al fumo (15). Conseguentemente all’introduzione del concetto di periodotal debridement si sono sviluppate tecniche di terapia non chirurgiche mininvasive definite come minimally invasive non surgical techniques (MINST). La procedura MINST si ottiene attraverso il periodontal debridement in anestesia locale, utilizzando prevalentemente strumenti ultrasonici con tips di piccole dimensioni (fig. 1) per lavorare in difetti stretti e profondi con anatomie difficili e sfruttando la magnificazione (loupes o microscopi operatori) (16).
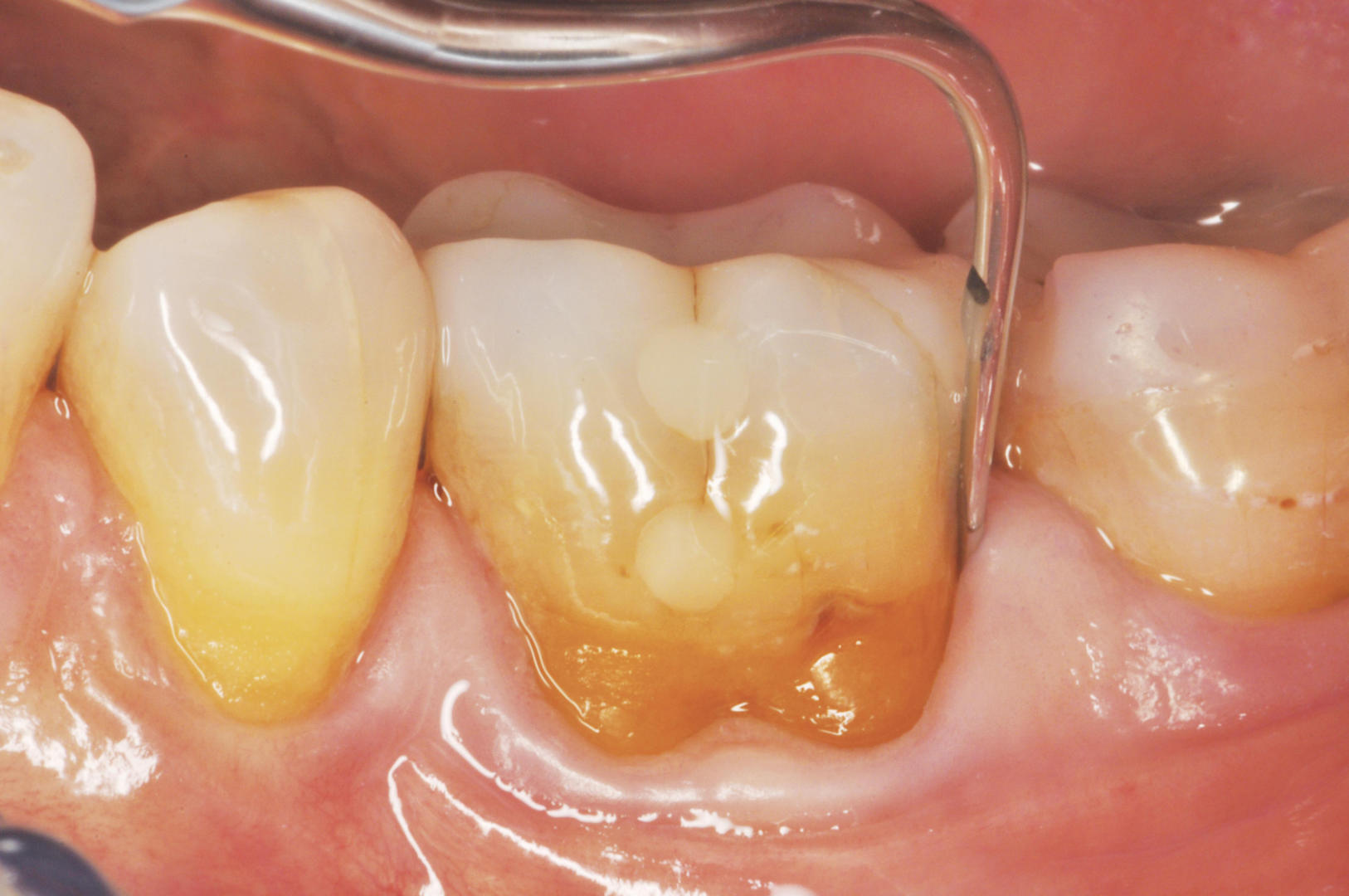
Per massimizzare la guarigione e poter parlare di MINST è di conseguenza necessario tener presente le motivazioni biologiche che portano alla conservazione dell’architettura gengivale iniziale, creando una ferita di minima entità con una gestione delicata dei tessuti duri e molli favorente la stabilità del coagulo all’interno della ferita.
La scelta di adottare lo strumento ad ultrasuoni, in particolare quello piezoelettrico, deriva dal fatto che risulta essere lo strumento che, a parità di efficacia, irruvidisce e rimuove meno cemento radicolare rispetto alla curette (17). Per esprimere al meglio la mininvasività è necessario però conoscere adeguatamente frequenza e ampiezza di vibrazione che rappresentano dei parametri fondamentali. Nello stesso modo anche gli strumenti air-polishing (air polishing devices, APD) con polveri a bassa abrasività, come glicina ed eritritolo, giocano un ruolo importante durante le manovre di debridement. Questi strumenti sono in grado di rimuovere efficacemente il biofilm batterico con gli stessi risultati degli strumenti tradizionali, ma sicuramente con un indice di abrasività quasi nullo per i tessuti del dente e per i materiali resinosi e ceramici.
Considerando il comfort per il paziente, l’ergonomia di utilizzo e la riduzione del tempo impiegato, gli APT sono strumenti efficienti e sicuri (18). Nonostante l’efficienza, resta ancora non dimostrato un vantaggio nell’utilizzo degli strumenti APD nell’ambiente sopra e sottogengivale in termini di efficacia durante lo step 2 (19) (fig. 2).
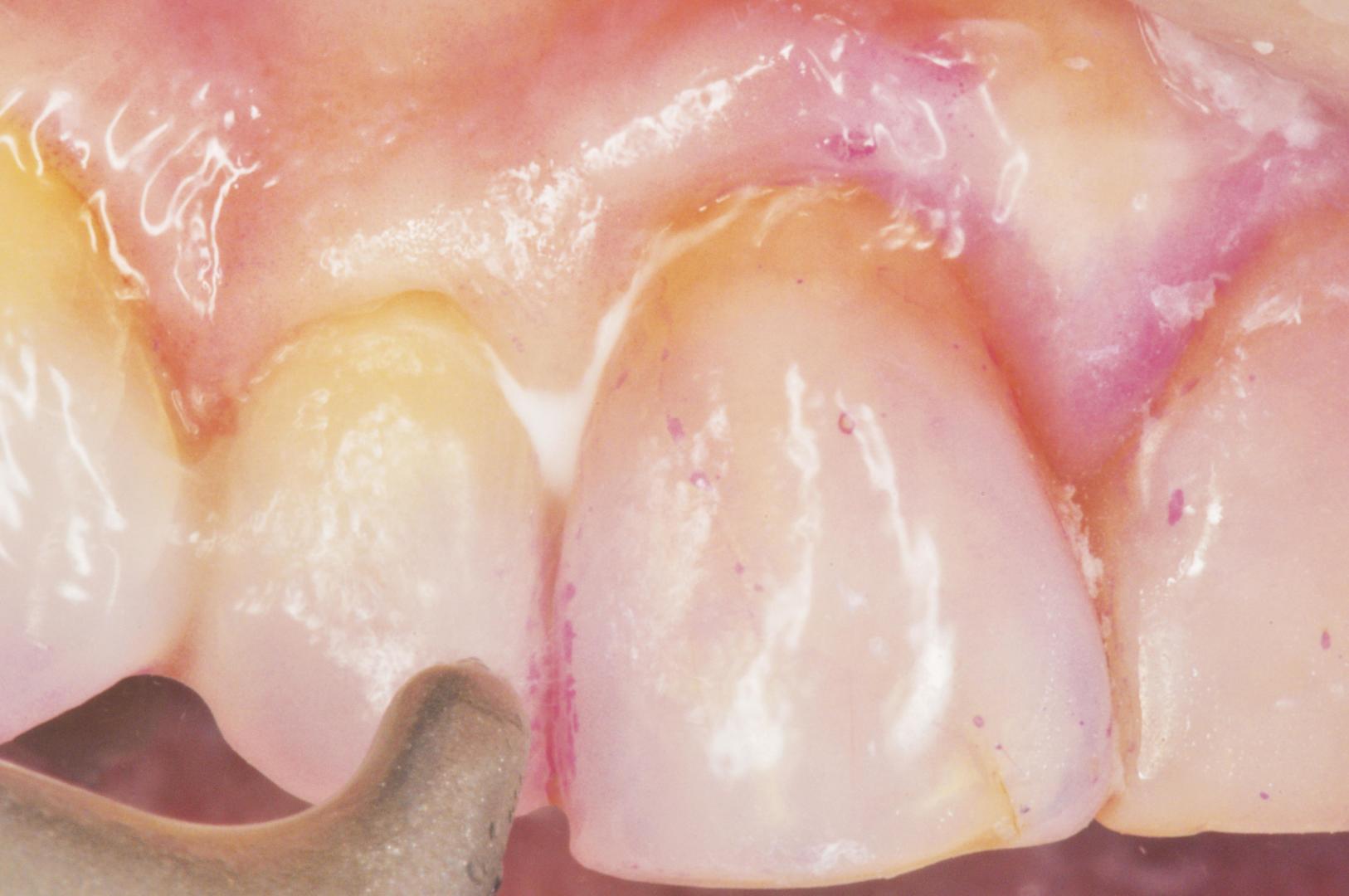
Il gruppo di Nibali (16), utilizzando MINST, ha ottenuto valori medi di CALgain di 2,56 mm e di riduzione del PD di 3,13 mm: questi dati preliminari sono promettenti ed evidenzierebbero un miglior effetto riparativo rispetto a quelli che si ottengono con la terapia tradizionale. Anche in termini di percentuale di chiusura della tasca i dati sono incoraggianti: nel lavoro di Ghezzi (20) mediamente sono state chiuse il 72% delle tasche a 2 mesi dallo step 2 con un CALgain di 1,7mm e una riduzione media di PD di 2.2mm. Le tasche con PD ≥ 7mm hanno avuto una migliore risposta in termini sia nella PDred sia nel CALgain in linea con il lavoro di Nibali (tabella 1).
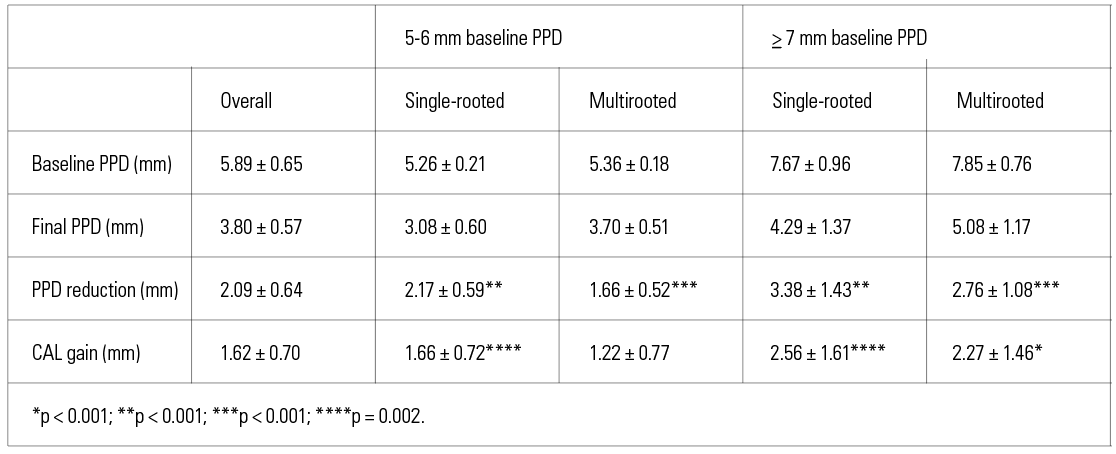
Questi dati trovano riscontro anche nel lavoro di Mensi (19) in cui si arriva al 78% di pocket closure a 3 mesi e nell’analisi di Iorio-Siciliano (21), 74% a 6 mesi. L’individuale risposta del paziente viene di solito rivalutata dopo 2-3 mesi dallo step 2 per stabilire la necessità di un eventuale step 3, ovvero la risoluzione delle tasche che non hanno risposto alla terapia attraverso ulteriori trattamenti, spesso chirurgici.
Lo step 3 può infatti comprendere sia un reintervento non chirurgico con sessioni ripetute con o senza terapie aggiuntive, sia la chirurgia parodontale con lembo per accesso, resettiva o rigenerativa. La decisione di un eventuale reintervento non chirurgico dipende dalle caratteristiche dei sondaggi residui; sappiamo che la maggior probabilità di conversione la si ottiene con tasche profonde fino a 6mm, viceversa per quelle profonde oltre i 7mm la probabilità è drasticamente inferiore e dovrebbe essere valutato invece un approccio chirurgico. Il successo nel ritrattamento dipende inoltre dalla presenza di fattori di rischio paziente, diabete non controllato e fumo, e da quelli relativi al sito come la presenza di placca e l’anatomia radicolare (mono e pluriradicolati) (15). Mediamente la percentuale di conversione con terapia non chirurgica nello step 3 è dell’11-17% delle tasche residue al termine dello step 2 (14).
Dopo il completamento della terapia parodontale attiva, i pazienti con parodontite trattati con successo devono entrare in terapia di supporto (supportive periodontal care, SPC – step 4) anch’essa condotta oggi con strumenti minimamente invasivi, eseguendo un PMPR che prevalentemente utilizza strumenti a polvere con l’ausilio di ultrasuoni in maniera selettiva sui depositi mineralizzati. Nelle eventuali tasche residue presenti nel paziente in remission control e ad alto rischio, verrà eseguita inoltre l’APT con strumenti a ultrasuoni abbinati a tips sottili e strumenti manuali di piccole dimensioni. La SPC è una terapia fondamentale che accompagna il paziente per tutta la vita al fine di mantenere la salute parodontale ottenuta con la terapia e intercettare precocemente qualunque cambiamento e/o recidiva. In conclusione, la malattia parodontale influisce negativamente sulla funzione masticatoria e sull’estetica, gravando enormemente sulla sfera emozionale e sociale; ha un effetto diretto a livello psicologico sulla vita di relazione, limitando la capacità di sorridere in pubblico e di interagire con gli altri arrivando ad una progressiva perdita dell’autostima. Il trattamento della malattia, in particolare dopo circa 1 mese dalla terapia non-chirurgica, è in grado di fornire dei miglioramenti per quanto riguarda la percezione del benessere fisico e mentale, migliorando la felicità e la qualità della vita (22).
Tonetti MS, Bottenberg P, Conrads G, Eickholz P, Heasman P, Huysmans MC, López R, Madianos P, Müller F, Needleman I, Nyvad B, Preshaw PM, Pretty I, Renvert S, Schwendicke F, Trombelli L, van der Putten GJ, Vanobbergen J, West N, Young A, Paris S.Dental caries and periodontal diseases in the ageing population: call to action to protect and enhance oral health and well-being as an essential component of healthy ageing – Consensus report of group 4 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases J Clin Periodontol. 2017 Mar;44 Suppl 18:S135-S144. doi: 10.1111/jcpe.12681.
Aimetti M, Perotto S, Castiglione A, Mariani GM, Ferrarotti F, Romano F. Prevalence of periodontitis in an adult population from an urban area in North Italy: findings from a cross-sectional population-based epidemiological survey. Journal of Clinical Periodontology. 42(7):622-31. doi: 10.1111/jcpe.12420. Epub 2015 Jun 25.
Papapanou PN, Sanz M, Buduneli N, Dietrich T, Feres M, Fine DH, Flemmig TF, Garcia R, Giannobile WV, Graziani F, Greenwell H, Herrera D, Kao RT, Kebschull M, Kinane DF, Kirkwood KL, Kocher T, Kornman KS, Kumar PS, Loos BG, Machtei E, Meng H, Mombelli A, Needleman I, Offenbacher S, Seymour GJ, Teles R, Tonetti MS. Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018 Jun;89 Suppl 1:S173-S182. doi: 10.1002/JPER.17-0721.
Sanz M, Herrera D, Kebschull M, Chapple I, Jepsen S, Beglundh T, Sculean A, Tonetti MS; EFP Workshop Participants and Methodological Consultants.Treatment of stage I-III periodontitis-The EFP S3 level clinical practice guideline J Clin Periodontol. 2020 Jul;47 Suppl 22(Suppl 22):4-60. doi: 10.1111/jcpe.13290.
Herrera D, Sanz M, Kebschull M, Jepsen S, Sculean A, Berglundh T, Papapanou PN, Chapple I, Tonetti MS; EFP Workshop Participants and Methodological Consultant. Treatment of stage IV periodontitis: The EFP S3 level clinical practice guideline J Clin Periodontol. 2022 Jun;49 Suppl 24:4-71. doi: 10.1111/jcpe.13639.
Raspini M., Cavalcanti R., Clementini M., Crea A., Di Stefano M., Fratini A., Karaboue M., Lacasella GV., Landi L., Larussa R., Littarru C., Sforza NM., Cairo F. (2021) La Parodontite e gli Italiani (2016-2020): necessità di linee guida per implementare una terapia efficace. Dental Cadmos. 89 (5): 346-356. Doi: 10.19256/d.cadmos.05.2021.05
Maurizio S. Tonetti, Peter Eickholz, Bruno G. Loos, Panos Papapanou, Ubele van der Velden, Gary Armitage, et al. Principles in prevention of periodontal diseases: Consensus report of group 1 of the 11th European Workshop on Periodontology on effective prevention of periodontal and peri-implant diseases. J Clin Periodontol.2015 Apr;42 Suppl 16:S5-11. doi: 10.1111/jcpe.12368.
Costa FO, Santuchi CC, Lafes EJ, Cota LO, Cortelli SC et all.Prospective Study in Periodontal Maintenance Therapy: Comparative Analysis Between Academic and Private Practices. J Periodontol. 2012 Mar;83(3):301-11. doi: 10.1902/jop.2011.110101. Epub 2011 Jul 22.
Ower P. Minimally invasive non-surgical periodontal therapy. Dent Update 2013;40(4):289–295. DOI: 10.12968/denu.2013.40.4.289.
Nyman S, Sarhed G, Ericsson I, et al. Role of “diseased” root cementum in healing following treatment of periodontal disease. an experimental study in the dog. J Periodont Res 1986;21(5):496–503. DOI: 10.1111/j.1600-0765.1986.tb01485.x.
Armitage GC, Xenoudi P. Post-treatment supportive care for the natural dentition and dental implants. Periodontol 2000 2016;71(1):164–184. DOI: 10.1111/prd.12122.
Tomasi C, Liss A, Welander M, Alian AY, Abrahamsson KH, Wennström JL. A randomized multi-centre study on the effectiveness of non-surgical periodontal therapy in general practice J Clin Periodontol. 2022 Nov;49(11):1092-1105. doi: 10.1111/jcpe.13703. Epub 2022 Jul 27. PMID: 35833528
Graziani F, Karapetsa D, Alonso B, Herrera D. Nonsurgical and surgical treatment of periodontitis: how many options for one disease? Periodontol 2000 2017 Oct;75(1):152-188. doi: 10.1111/prd.12201.
Suvan, J., Leira, Y., Moreno, F., Graziani, F., Derks, J., & Tomasi, C. (2020). Subgingival instrumentation for treatment of periodontitis. A sys- tematic review. Journal of Clinical Periodontology, 47(Suppl 22), 155– 175. https://doi.org/10.1111/jcpe.13245
Tomasi C, Leyland AH, Wennstro ̈m JL. Factors influencing the outcome of non-surgical periodontal treatment: a multilevel approach. J Clin Periodontol 2007; 34: 682–690. doi: 10.1111/j.1600-051X.2007.01111.x.
Nibali L. D. Pometti, T. T. Chen, and Y. K. Tu. “Minimally invasive non-surgical approach for the treatment of peri- odontal intrabony defects: a retrospective analysis,” Journal of Clinical Periodontology, vol. 42, no. 9, pp. 853–859, 2015.
Santos FA, Pochapski MT, Leal PC, et al. Comparative study on the effect of ultrasonic instruments on the root surface in vivo. Clin Oral Invest 2008;12(2):143–150. DOI: 10.1007/s00784-007-0167-3.
Bühler J, Amato M, Weiger R, et al. A systematic review on the effects of air polishing devices on oral tissues. Int J Dent Hygiene 2016;14(1):15–28. DOI: 10.1111/idh.12120.
Mensi M, Scotti E, Sordillo A, Calza S, Guarnelli ME, Fabbri C, Farina R, Trombelli L.Efficacy of the additional use of subgingival air polishingwith erythritol powder in the treatment of periodontitis patients: a randomized controlled clinical trial Clin Oral Investig. 2021 Feb;25(2):729-736. doi: 10.1007/s00784-020-03648-z. Epub 2021 Jan 6.
Ghezzi C., L. Ferrantino, C. Donghi, S. Vaghi, V. Viganò, D. Costa, M. Mandaglio, A. Pispero, G. Lodi. “Clinical Audit of Minimally Invasive Nonsurgical Techniques in Active Periodontal Therapy” J Contemp Dent Tract. 2020 Apr 1;21(4):431-437.
Iorio-Siciliano V., L. Ramaglia, G. Isola, A. Blasi, G.E. Salvi, A. Sculean, “Changes in clinical parameters following adjunctive local sodium hypochlorite gel in minimally invasive nonsurgical therapy (MINST) of periodontal pockets: a 6-month randomized controlled clinical trial” Clinical Oral Investigations (2021) 25:5331–5340
Botelho J, Machado V, Proença L, Bellini DH, Chambrone L, Alcoforado G, Mendes JJ.The impact of nonsurgical periodontal treatment on oral health-related quality of life: a systematic review and meta-analysis Clin Oral Investig. 2020 Feb;24(2):585-596. doi: 10.1007/s00784-019-03188-1. Epub 2020 Jan 4