INTRODUZIONE
Attualmente gli impiantidentali rappresentano una tra le opzioni terapeutiche più frequentemente utilizzate per la sostituzione dei denti mancanti, avendo dimostrato nel tempo la loro efficacia, predicibilità , prognosi favorevole a lungo termine oltre che elevata percentuale di sopravvivenza (dal 95% al 99% ) (1, 2, 3, 4, 5).
A causa del sempre crescente numero di impianti posizionati è esponenzialmente aumentata anche la frequenza delle complicanze che sono correlabili principalmente al protrarsi del periodo di permanenza intraorale della fixture. Le complicanze più frequentemente riscontrabili sono quelle di natura infiammatoria che si evidenziano attraverso manifestazioni cliniche note come mucosite e periimplantite. La mucosite periimplantare è l’infiammazione della mucosa intorno alla fixture, mentre il termine periimplantite viene utilizzato per descrivere la presenza di uno stato infiammatorio della mucosa associato ad una perdita della struttura ossea di sostegno.
Analizzando la letteratura si evidenzia che la prevalenza (rapporto fra il numero di eventi sanitari rilevati in una popolazione in un determinato momento e il numero degli individui della popolazione osservati nello stesso periodo) delle malattie periimplantari è a favore delle mucositi (circa l’80% dei pazienti ed il 50% dei siti) rispetto alle periimplantiti (28-56% dei pazienti e 12-43% dei siti) (6, 7, 8, 9).
Contrariamente alle aspettative, le infezioni si presentano con una incidenza annuale inferiore (numero di nuovi casi di una data malattia in un determinato lasso di tempo), solitamente compresa tra lo 0,5% e il 3% (1).
EZIOLOGIA
Da un punto di vista clinico i ben noti fattori di rischio della parodontite possono essere considerati in uguale modo per la patologia periimplantare. I pazienti suscettibili alla malattia parodontale sembrano esserlo anche e maggiormente per le affezioni periimplantari (10).
I risultati di diversi studi indicano che il fumo è frequentemente associato alle infiammazioni periimplantari, rappresentando un importante fattore di rischio. Numerose ricerche hanno rilevato come i tassi di sopravvivenza siano statisticamente più bassi nei fumatori rispetto ai non fumatori e che l’abbinamento della parodontopatia con il fumo aumenti considerevolmente il rischio di fallimento implantare (11, 12, 13). Tra i fattori di rischio possiamo annoverare anche la scarsa igiene orale come evidenziato in diversi lavori (14, 15). Se la scarsa igiene orale, la pregressa malattia parodontale ed il fumo sono fattori di rischio per le malattie infiammatorie periimplantari, questo non risulta altrettanto chiaro per quanto riguarda il diabete (con scarso controllo metabolico) (15) ed il consumo di alcool (per quantitativi superiori ai 10 g/ die) (16). Scarsi e contrastanti sono i risultati che scaturiscono cercando correlazioni tra cariotipo e malattie periimplantari (17, 18) e tra quest’ultime ed il condizionamento delle superfici implantari (19, 20).
PATOGENESI
Il principio che i microrganismi siano essenziali per lo sviluppo delle infezioni intorno agli impianti e che la colonizzazione batterica delle loro superfici si verifica rapidamente appena dopo l’inserimento (10, 11, 12, 13) è ben supportato dalla letteratura (22, 25, 26, 27, 28, 29). Questo ci permette di affermare che la patogenesi risulta correlata alla presenza di un biofilm contenente microrganismi (prevalentemente Gramnegativi anaerobi simili) paragonabili a quelli che normalmente si riscontrano nella malattia parodontale e come le tasche parodontali, soprattutto se adiacenti, possano comportarsi da focolaio infettante (29, 30, 31).
Se l’iniziale risposta dell’ospite ai batteri appare nella mucosite identica a quella riscontrata nella gengivite, un accumulo di batteri persistente può indurre una risposta infiammatoria più marcata nei tessuti mucosi periimplantari rispetto a quelli che si verificano nell’unità dento-gengivale, forse a causa delle differenze strutturali quali la vascolarizzazione o i rapporti fibroblasti- collagene. Nelle mucositi e periimplantiti prodotte sperimentalmente con l’applicazione di legature placca-ritentive, l’evoluzione segue una sequenza di eventi molto simile a quella che si sviluppa nella malattia parodontale, tuttavia in alcuni casi avviene inspiegabilmente più velocemente (32).
PERIIMPLANTITE RETROGRADA
Recentemente è stato coniato in alcuni case report il termine “periimplantite retrograda”, indicando una lesione che si manifesta nella regione apicale della fixture (33, 34, 35).
La lesione si sviluppa poco dopo l’inserimento dell’impianto nella sua zona periapicale, mentre la sua porzione coronale raggiunge una normale osteointegrazione. Questo tipo di lesioni sono diagnosticabili solo radiograficamente tramite l’evidenziazione di una radiotrasparenza (35).
Generalmente sono accompagnate da sintomi quali dolore e gonfiore che spesso esitano in una fistola (36). I fattori eziologici che portano alle periimplantiti retrograde includono il surriscaldamento, la compressione dell’osso durante il posizionamento dell’impianto, la presenza di infiammazioni/ infezioni preesistenti derivanti sia da denti adiacenti sia dal sito impiantare stesso (37).
Le radiografie prechirurgiche, per quanto necessarie per verificare il sito implantare e i denti adiacenti, anche se non evidenziano lesioni nell’area periapicale, possono non indicare la presenza di microrganismi preesistenti che possono invadere o contaminare l’impianto (38, 39, 40).
Secondo Wei Zhou, aumentando il tempo di attesa tra trattamento endodontico del dente adiacente e posizionamento dell’impianto e/o incrementando la distanza tra fixture e dente adiacente, si può prevenire la periimplantite retrograda (41).
Il ritrattamento del dente adiacente può risultare la scelta più vantaggiosa per le piccole lesioni implantari, mentre per quelle di maggior diametro la detossificazione della superficie implantare contaminata con la contemporanea rimozione chirurgica del tessuto di granulazione determina una riduzione del riassorbimento osseo (36, 41, 42, 43).
DIAGNOSI
La diagnosi delle infiammazioni avviene principalmente tramite il sondaggio utilizzando una forza leggera (0,25 N) per evitare di danneggiare l’attacco ed i tessuti periimplantari (44, 45). Forze più alte farebbero penetrare la sonda oltre il sigillo marginale fino a farla giungere in prossimità dell’osso. La presenza di sanguinamento e/o pus durante tale manovra indica uno stato infettivo/infiammatorio della mucosa ed è un fattore predditivo di perdita di tessuto di sostegno.
L’infezione determina un progressivo aumento del sondaggio dovuto inizialmente alla tumefazione dei tessuti marginali e successivamente alla perdita di osso ed attacco epiteliale. La profondità di sondaggio, il sanguinamento e la mobilità (quest’ultima predditiva di perdita di osteointegrazione) dovrebbero essere valutati regolarmente. Anche i radiogrammi risultano indispensabili per la valutazione dell’osso di supporto. Misurazioni parodontali e radiografie iniziali dovrebbero essere effettuate a terapia ultimata per permettere un continuo monitoraggio nel tempo delle condizioni dei tessuti periimplantari (46).
Secondo i criteri proposti per verificare il successo implantare, la perdita d’osso marginale non dovrebbe superare 1,5 mm durante il primo anno di funzione ed essere inferiore a 0,2 mm/ anno in quelli successivi (47, 48). Una modifica a questi criteri è stata apportata durante l’European Workshop on Periodontology del 1999. In quella sede si concluse che per avere il successo implantare la perdita di osso massima fosse di 2 mm tra l’installazione della protesi e i 5 anni successivi (49). Il principio generale di usare la diminuzione annuale dell’osso periimplantare come criterio di successo può essere messo in discussione, dato che i valori suggeriti (inferiore a 0,2 mm dopo il primo anno di carico) possono includere perdite d’osso compatibili con una forma infiammatoria che, pur variando da soggetto a soggetto, è in molti casi caratterizzata da una progressione non lineare con tasso crescente nel tempo (50) (figg. 1 e 2).
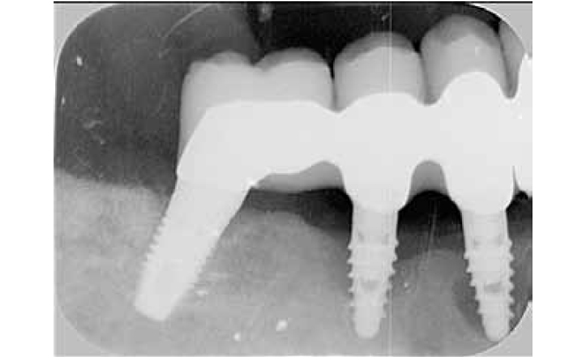
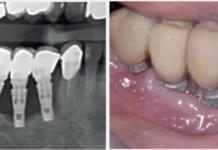
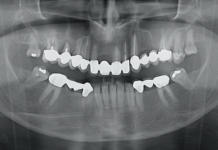
Radiogrammi di perimplantite multipla.
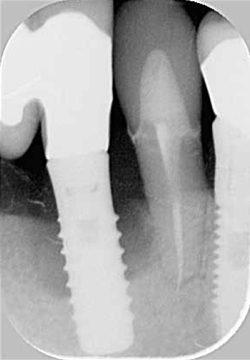
Radiogrammi di perimplantite singola.
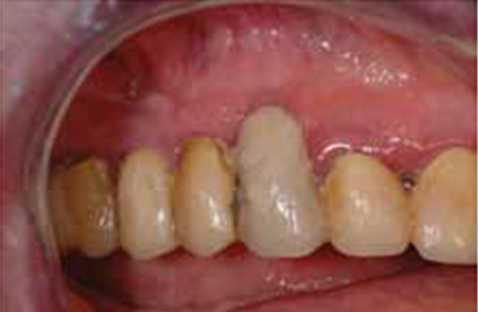
Mucosite perimplantare.
Ricapitolando, i segni clinici delle malattie periimplantari sono il sanguinamento al sondaggio, il riscontro di suppurazione, la recessione gengivale, la presenza di fistole, la tumefazione della mucosa periimplantare e l’aumento della profondità di sondaggio. In quest’ultimo caso è importante distinguere tra il rimodellamento osseo che normalmente avviene dopo il posizionamento della fixture e l’inizio del carico protesico da quella dovuta a fenomeni infiammatori.
TERAPIA
Il trattamento proposto per le malattie periimplantari si basa su terapie assimilabili a quelle per le malattie parodontali e su valutazioni cliniche empiriche più che su evidenze scientifiche (51, 52, 53, 54, 55). Gli studi a disposizione sono scarsi, con brevi follow-up e basati su campioni di piccole dimensioni. Non è ancora chiaro quali siano le strategie terapeutiche più efficaci per il trattamento se si considera la morfologia, l’estensione e la severità della lesione.
I disegni della fixture associati al trattamento di superficie permettono un miglioramento dell’osteointegrazione, facilitando tuttavia l’adesione di un biofilm una volta che l’impianto è esposto all’ambiente orale, aumentando quindi la possibilità di infiammazione.
La terapia meccanica non chirurgica (scaling a cielo coperto) eseguita con curette (in carbonio o acriliche) e coppette di gomma con paste abrasive può essere efficace nel trattamento delle mucositi, inoltre l’aggiunta di antimicrobici topici aumenta le possibilità di successo di tale terapia (52, 53, 56). Il debridement di superficie costituisce la terapia base per il trattamento delle mucositi periimplantari e delle periimplantiti. Una riduzione della carica batterica che permetta la guarigione è difficile da attuare con i soli mezzi meccanici, quindi eventuali terapia aggiuntive quali antibiotici, antisettici, trattamenti laser e chirurgici sono stati proposti. In ogni caso la risoluzione dell’infezione deve precedere qualsiasi trattamento rigenerativo e dovrà prevedere, se indicato, la rimozione meccanica della placca, l’applicazione di antisettici, la somministrazione di antibiotici, il tutto supportato da un efficace programma di igiene orale domiciliare finalizzata alla riduzione del numero di patogeni presenti.
Un trattamento rigenerativo può essere indicato considerando l’ammontare della perdita ossea, la morfologia del difetto e la possibilità di decontaminare la superficie implantare. Sono stati proposti numerosi metodi per la detersione della superficie implantare: meccanici (curette e coppette di gomma), scaler ultrasonici (57), getti di polvere sotto pressione e trattamenti che prevedono l’utilizzo di sostanze chimiche (58). Uno studio che ha testato 6 antisettici (ipoclorito di sodio, perossido d’idrogeno, acido citrico, clorexidina, Listerine e Plax) ha dimostrato che tutti erano in grado di ridurre la quantità di microrganismi accumulatisi sulle superfici implantari. Attraverso queste osservazioni si è potuto considerare come l’utilizzo regolare di agenti antibatterici nella terapia delle periimplantiti, tenuto conto del loro basso costo e della facilità d’uso e dei minimi rischi a loro correlati (59), sia considerevolmente benefico. Alcuni autori preferiscono eseguire la decontaminazione di superficie esclusivamente con una soluzione salina sterile al fine di eliminare i potenziali effetti inibitori dei radicali liberi sulla riosteointegrazione (60).
Nonostante alcune procedure abbiano dimostrato qualche efficacia, soprattutto se ripetute nel tempo (61), nessuna ha dimostrato di essere risolutiva nella cura della patologia (62, 63).
In ogni caso la terapia non chirurgica si è dimostrata non predicibile, anche se l’aggiunta di antisettici, antibiotici locali (64, 65) o sistemici ha avuto effetti positivi. L’uso del laser ha mostrato anch’esso qualche effetto benefico, più che altro transitorio, necessitando di ulteriori studi per valutarne la reale efficacia (52, 53, 66, 67, 68).
L’alta tendenza alla reinfezione della tasca periimplantare (soprattutto oltre i 5 mm) può essere spiegata dalla limitata efficacia delle procedure di pulizia della superficie implantare che, non rimuovendo completamente i contaminanti batterici, impedisce il formarsi di un nuovo contatto osso-impianto (69). Al contrario, un trattamento chirurgico delle lesioni tramite debridement a cielo aperto permette un miglior accesso ed una successiva guarigione completamente sommersa. Quest’ultima infatti si è dimostrata una procedura più efficace nel promuovere e favorire la rigenerazione ossea ed il contatto osso-impianto (70).
Alcuni autori hanno notato come i risultati ottenuti dalle terapie chirurgiche rigenerative siano più predicibili che i semplici trattamenti non chirurgici (71, 72, 73, 74). In particolare, quando sono stati utilizzati vari tipi di innesti ossei, con o senza l’applicazione di una membrana, si è costatato un miglioramento clinico e radiologico nei 6-12 mesi successivi l’intervento (71, 74). La loro stabilità a lungo termine sembra essere principalmente influenzata dalle proprietà fisico-chimiche dei sostituti d’osso utilizzati e l’applicazione di un osso minerale naturale in combinazione con una membrana di collagene ha mostrato un miglioramento clinico nei 4 anni successivi. L’utilizzo di una idrossiapatite nanocristallina ha dato scarsi risultati a lungo termine (72, 73).
Da un punto di vista biologico bisogna considerare come i risultati di un trattamento chirurgico rigenerativo potrebbero anche essere influenzati dalla configurazione del difetto. Le lesioni che più comunemente si riscontrano sono rappresentate dai difetti sovracrestali e da quelli infraossei. Se il trattamento rigenerativo di ampi difetti sovracrestali può essere impegnativo, questo approccio sembra essere particolarmente adatto per i difetti infraossei. Il difetto infraosseo è solitamente circolare presentando la conservazione della corticale vestibolare e linguale per tutta la circonferenza. Uno studio che ha trattato i difetti infraossei con tecnica rigenerativa (lembo a spessore totale, eliminazione del tessuto di granulazione con curette in carbonio, decontaminazione della superficie implantare con pellet di cotone imbevuti in soluzione salina sterile, osso più membrana riassorbibile) ha evidenziato come i difetti circolari con mantenimento delle pareti buccali e orali avessero una prognosi favorevole (75). Utile ai fini diagnostici e terapeutici è l’albero decisionale sviluppato dall’Università di Berna (tab. 1).

CONCLUSIONI
Sarebbe opportuno informare i pazienti che i tessuti periimplantari rispondono agli accumuli di placca in maniera similare a quella dei tessuti parodontali, quindi una igiene orale scarsa può causare la malattia periimplantare. È imperativo trattare la malattia parodontale prima dell’inserimento dell’impianto e seguire il paziente in un corretto programma di igiene orale. Il clinico dovrebbe registrare le condizioni di partenza con sondaggio e radiografia e ripetere queste misurazioni almeno annualmente al fine di monitorare le condizioni dell’impianto. La diagnosi precoce è fondamentale per cercare di evitare la completa perdita di osteointegrazione con conseguente fallimento dell’impianto. Infatti le periimplantiti sono difficili da curare e i risultati non sono prevedibili. Se la terapia meccanica non chirurgica non risolve la lesione sono indicati l’aggiunta di antimicrobici e di un lembo di accesso chirurgico. Al fine di ripristinare il difetto osseo può essere presa in considerazione la chirurgia rigenerativa.
Bibliografia
- Berglundh T, Persson L, Klinge B. A systematic review of the incidence of biological and technical complications in implant dentistry reported in prospective longitudinal studies of the least 5 years. Journal of Clinical Periodontology 2002;29:197-212.
- Lang NP, Pjetursson BE, Tank K, Bragger U, Egger M, Zwahlen M. A systematic review of the survival and complication rates of fixed partial dentures (FPDs) after an observation period of at least 5 years. II. Combined tooth-implant-supported FPDs. Clinical Oral Implants Research 2004;15:643-53.
- Pjetursson B, Tan K, Lang N, Bragger U, Egger M, Zwahlen M. A systematic review of the survival and complication rates of fixed partial dentures (FPDs) after an observation period of at least 5 years. I. Implant-supported FPDs. Clinical Oral Implants Research 2004;15:625-42.
- Bowen A, Pascua G, Nasimi A. Infections in implantology: from prophylaxis to treatment. Medicina Oral Patologia Oral Y Cirugia Bucal 2007;12:E323-30.
- Pjetursson B, Lang N. Prosthetic treatment planning on the basis of scientific evidence. J Oral Rehabil 2008;35 (Suppl I):72-9.
- Fransson C, Lekholm U, Jemt T, Berglundh T. Prevalence of nsubjects with progressive bone loss at omplants. Clinical Oral Implants Research 2005;16:440-6.
- Roos-Jansaker A, Lindahl C, Renvert H, Renvert S. Nine-tofourteen-year follow-up of implant treatment. Part II: presence of peri-implant lesions. Journal of Clinical Periodontology 2006;33:290-5.
- Renvert S, Roos-Jansaker A, Lindahl C, Renvert H, Persson R. Infection at titanium implants with or without a clinical diagnosis of inflammation. Clinical Oral Implants Research 2007;18:509-16.
- Zitzmann N, Berglundh T. Definition and prevalence of periimplant disease. Journal of Clinical Periodontology 2008;35 (Suppl. 8):286-91.
- Ong C, Ivanoski S, Needleman I, Retzepi M, Moles D, Tonetti M et al. J Clin Periodontol 2008;35:438-62.
- Strietzel F, Reichart P, Kale A, Kulkarni M, Wegner B, Kuchler I. Smoking interferes with the prognosis of dental implant treatment: a systematic review and meta-analysis. Journal of Clinical Periodontology 2007;34:523-44.
- Heitz-Mayfield L., Huynh-Ba G. History of treated periodontitis and smoking as risk for implant therapy. Int J Oral Maxillofac Implants 2009;24 Suppl:39-68.
- Carcuac O, Jansson L. Peri-implantitis in a specialist clinic of periodontology. Clinical features and risk indicators. Swed Dent J 2010;34(2):53-61.
- Lindquist L, Carlsson G, Jemt T. Association between marginal bone loss around osseointegrated mandibular implants and smoking habitus: a 10-year follow-up study. Journal of Dental Research 1997;76:1667-74.
- Ferriera S, Silva G, Cortelli J, Costa J, Costa F. Prevalence and risk variables for peri-implant desease in Brazilian subjects. Journal of Clinical Periodontology 2006;33:929-35.
- Galindo-Moreno P, Fauri M, Avila-Ortiz G, Fernandez-Barbero J, Cabrera-Leon A, Sanchez-Fernandez E. Influence of alcohol and tabacco habitus on peri-implant marginal bone loss: a prospective study. Clinical Oral Implants Research 2005;16:579-86.
- Laine M, Leonhardt A, Roos-Jansaker A, Pena A, van Winkelhoff A, Wimkle E, Renvert S. IL-1RN gene polymorphism is associated with peri-implantitis. Clinical Oral Implants Research 2006;17:380-5.
- Lachmann S, Kimmerle-Muller E, Axmann D, Scheideler L, Weber H, Haas R. Associations between peri-implant crevicular fluid volume, concentrations of crevicular inflammatory mediators and composite IL-1 -889 and IL-1B +3954 genotype. A cross-sectional study on implant recall patients with and without clinical signs of peri-implantits. Clinical Oral Implants Research 2007;18:212-23.
- Astrand P, Engquist B, Anzen B, Bergendal T, Hallman M, Karlsson U, Kvint S, Lysell L, Rundcranz T. A three-year follow-up report of a comparative study of ITI Dental Implants and Brånemark Syste implants in the treatment of the partially edentolous maxilla. Clinical Implant Dentistry and Related Research 2004;6:130-41.
- Wennstrom J, Ekestubbe A, Grondahl K, Karlsson S, Lindhe J. Oral rehabilitation with implant-supported fixed partial dentures in periodontitis-susceptible subjects. A 5-year prospective study. Journal of Clinical Periodontology 2004;31:713-24.
- Van Winkelhoff A, Goene R, Benschop C, Folmer T. Early colonization of dental implants by putative periodontal pathogens in partially edentolous patients. Clinical Oral Implants Research 2000;11:511-20.
- Quirynen M, Vogels R., Peeters W., van Steenberghe D., Naertn I. e Haffajee A. Dynamics of initial subgingival colonization of “pristine” peri-implant pockets. Clinical Oral Implants Research 2006;17:25-37.
- Furst M, Salvi G, Lang N, Persson G. Bacterial colonization immediately after installation on oral titanium implants. Clinical Oral Implants Research 2007;18:501-8.
- Salvi G, Furst M, Lang N, Persson G. One-year bacterial colonization patterns of Staphilococcus aureus and other bacteria at implant and adjacent teeth. Clinical Oral Implants Research 2008;19:242-8.
- Pontoriero R, Tonelli M, Carnevale G, Mombelli A, Nyman S, Lang N. Experimentally induced peri-implant mucositis. A clinical study in humans. Clinical Oral Implants Research 1994;5:254-9.
- Salcetti J, Moriarty J, Cooper L, Smith F, Collins J, Socranscky S, Offenbacher S. The clinical, microbial and host response characteristics of the failing implant. The International Journal of Oral and Maxillofacial Implants 1997;12:32-42.
- Mombelli A, Lang N. The diagnosis and treatment of periimplantitis. Periodontology 2000 1998;17:63-76.
- Leonhardt A, Renvert S, Dahlen G. Microbial findings at failing implants. Clinical Oral Implant Research 1999;10:339-45.
- Quirynen M, De Soete M, van Steenberghe D. Infectious risks for oral implants: a review of the literature. Clinical Oral Implant research 2002;13:1-19.
- Mombelli A. Microbiology and antimicrobial therapy of periimplantitis. Periodontology 2000 2002;28:177-89.
- Aoki M, Takanashi K, Matsukubo T, Yajima Y, Okuda K, Sato T, Ishihara K. Transmission of periodontopathic bacteria from natural teeth to implants. Clin Implant Dent Relat Res 2010.
- Heitz-Mayfield L, Lang N. Comparative biologyof chronic and aggressive periodontitis vs. peri-implantitis. Periodontol 2000 2010;53:167-81.
- Ayangco L, Sheridan PJ. Development and treatment of retrograde peri-implantitis involving a site with a history of failed endodontic and apicoectomy procedures: a series of reports.The international Journal of Oral and Maxillofacial Implants 2001;16:412-7.
- Jalbout ZN, Tarnow DP. The implant periapical lesion: four case reports and review of the literature. Pratical Procedures and Aesthetic Dentistry 2001;13:107-12.
- Quirynen M, Gijbels F, Jacobs R. An infected jawbone site compromising successful osseointegration. Periodontology 2000 2003;33:129-44.
- Quirynen M, Vogels R, Alsaadi G, Neart I, Jacobs R, Van Steenberghe D. Predisposing conditions for retrograde periimplantitis, and treatment suggestions. Clinical Oral Implants Research 2005;16:599-608.
- Sussman HI, Moss SS. Localized osteomyelitis secondary to endodontic-implant pathosis. A case report. Journal ofPeriodontology 1993;64:306-10.
- Green TL, Walton RE, Taylor JK, Merrel P. Radiographic and histologic periapical findings of root canal treated teeth in cadaver. Oral Surgery, Oral Medicine, Oral Patology, OralRadiology and Endodontics 1997;83:707-11.
- Seltzer S. Long-term radiographic and histological observations of endodontically treated teeth. Journal of Endodontics 1999;25:818-22.
- Brisman DL, Brisman AS, Moses MS. Implant failures associated with asymptomatic endodontically treated teeth. Journal of the American Dental Association 2001;132:191-5.
- Wei Zhou, Han C, Li D, Li Y, Song Y, Zhao Y. Endodontic treatment of teeth induces retrograde peri-implantitis. Clin Oral Implants Res 2009;20:1326-32.
- Carrotte P. Surgical endodontics. British Dental Journal 2005;198: 71-9.
- Tseng CC, Chen YH, Pang IC, Weber HP. Peri-implant pathology caused by periapical lesion of an adjacent natural tooth: a case report. The International Journal of Oral and Maxillofacial Implants 2005;20:632-5.
- Lang N, Wetzel A, Stich H, Caffesse R. Histologic probe penetration in healthy and inflamed peri-implant tissues. Clinical Oral Implants Research 1994;5: 91-201.
- Schou S, Holmstrup P, Stolte K, Hjorting-Hansen E, Fiehn N, Skovgaard L. Probing around implants and teeth with healthy or inflamed peri-implant mucosa/gingiva. A histologic comparison in cynomolgus monkeys 2002;13:113-26.
- Heitz-Mayfield L. Peri-implant diseases: diagnosis and risk indicators. Clinical Oral Implants Research 2008;35(Suppl. 8):292-304.
- Albrektsson T, Zarb G. Current interpretations of thebosseointegrated response: clinical significance. International Journal of Prostodontics 1993;6:95-105.
- Albrektsson T, Zarb G, Worthington P, Eriksson A. The long-term efficacy of currently used dental implants: a review and proposed criteria of success. International Journal of Oral and Maxillofacial Implants 1986;1:11-25.
- Wennstrom J, Palmer R. Consensus report of session 3: clinical trials. In: Lang, Karring and Lindhe (eds). Proceedings of the 3rd European Workshop on Periodontology. Berlin: Quintessenze. Implant Dentistry; 1999. p. 255-9.
- Fransson C, Wennstrom J, Tomasi C, Berlundh T. Extent of peri-implantitis-associated bone loss. Journal of Clinical Periodontology 2009;36:357-63.
- Lang N, Berglundh T, Heitz-Mayfield L, Pjetursson B, Salvid G, Sanz M. Consensus statements and recommended clinical procedures regarding implant survival and complications. International Journal og Oral and Maxillofacial Implants 2004;19(Suppl.):150-4.
- Kotsovilis S, Karoussis I, Trianti M, Fourmousis I. Therapy of peri-implantitis: a systematic revew. Journal of Clinical Periodontology 2008;35:621-9.
- Renvert S, Roos-Jansaker A, Claffey N. Non-surgical treatment of peri-implant mucositis and peri-implantitis: a literature review. Journal of Clinical Periodontology 2008;35:305-15.
- Duarte P, DE Mendonca A, Maximo M, Santos V, Bastos M, Nociti F. Effect of anti-infective mechanical therapy on clinical parameters and cytokine levels in human peri-implant diseases. Journal of Periodontology 2009;80:234-43.
- Maximo M, de Mendonca A, Santos V, de Figueiredo L, Feres M, Duarte P. Short-term clinical and microbiological evaluation of peri-implant diseases before and after mechanical anti-infective therapies. Clinical Oral Implants Research 2009;20:99-108.
- Porras R, Anderson G, Caffesse R, Narendran S, Trejo P. Clinical response to 2 different therapeutic regimens to treat periimplant mucositis. Journal of Periodontology 2002;73:1118-25.
- Karring E, Stavropoulos A, Ellegaard B, Karring T. Treatment of peri-implantitis by the Vectors system A pilot study. Clinical Oral Implants Research 2005;16:288-93.
- Schou S, Holmstrup P, Jrgensen T, Skovgaard L, Stoltze K, Hjorting-Hansen E, Wenzel A. Implant surface preparation in the surgical treatment of experimental peri-implantitis with autogenous bone graft and ePTFE membrane in cynomolgus monkeys. Clinical Oral Implants Research 2003;14:412-22.
- Gosau M, Hahnel S, Schwarz F, Gerlach T, Reichert T e Burgers R. Effect of six different peri-implantitis disinfection methods on in vivo human oral biofilm. Clin Oral Implants Res 2010;21:866- 72.
- Parlar A, Bosshardt D, Cetiner D, Schafroth D, Unsal B e Lang N. Effects of decontamination and implant surface characteristics on re-osseointegration following treatment of peri-implantitis 2009;20:391-9.
- Renvert S, Lessem J, Dahlen G, Renvert H, Lindahl C. Mechanical and repeated antimicrobial therapy using a local drug delivery system in the treatment of peri-implantitis: a randomized clinical trial. Journal of Periodontology 2008;79:836-44.
- Klinge B, Hultin M, Berglindh T. Periimplantitis. Dental Clinics of North America 2005;49:661-76.
- Esposito M, Grusovin M, Coulthard P, Worthington H. Interventios for replacing missing teeth: treatment of periimplantitis. Cochrane Database of Systemic Reviews 2006;19:CD004970.
- Pasquette D, Ryan M, Wilder R. Locally delivered antimicrobials:clinical evidence and relevance. J Dent Hyg 2008;82 (Suppl)3:10-5.
- Norowski P, Bumgardner J. Biomaterial and antibiotic strategies for peri-implantitis: a review. J Biomed Mater Res B Appl Biomater 2009;88:530-43.
- Schwarz F, Sculean A, Bieling K, Ferrari D, Rothamel D, Becker J. Clinical evaluation of an er:YAG laser for nonsurgical treatment of peri-implantitis: a pilot study. Clinical Oral Implants Research 2005;16:44-52.
- Schwarz F, Bieling K, Bonsmann M, Latz T, Becker J. Nonsurgical treatment of moderate and advanced periimplantitis lesions: a controlled clinical study. Clinical Oral Investigations 2006;10:279-88.
- Renvert S, Samuelsson E, Lindahl C, Persson G. Mechanical nonsurgical treatment of peri-implantitis: a double-blind randomized longitudinal clinical study. I: clinical results. Journal of Clinical Periodontology 2009;36:604-9.
- Schwarz F, Jepsen S, Herten M, Sager M, Rothamel D, Becker J. Influence of different treatment approaches on non-submerged and submerged healing of ligature induced peri implantitis lesions: an experimental study in dogs. Journal of Clinical Periodontology 2006;33:584-95.
- Renvert S, Polyzois I, Maguire R. Re-osseointegration on previously contaminated surfaces: a systematic review. Clinical Oral Implants research 2009; 20(Suppl. 4):216-27.
- Schwarz F, Bieling K, Latz T, Nuesry E, Becker J. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of Clinical Periodontology 2006;33:491-9.
- Schwarz F, Sculean A, Bieling K, Ferrari D, Rothamel D, Becker J. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of Clinical Periodontology 2008;35:80-7.
- Schwarz F, Sahm N, Bieling K, Becker J. Surgical regenerative treatment of peri-implantitis lesions using a nano-crystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane: a four-year clinical following-up report. Journal of Clinical Periodontology 2009;36:807-14.
- Roos-Jansaker A, Renvert H, Lindahl C, Renvert S. Surgical treatment of peri-implantitis using a bone substitute with or without a resorbable membrane: a prospective cohort study. Journal of Clinical Periodontology 2007;34:625-32.
- Schwarz F, Sahm N, Schwarz K, Becker J. Impact of defect configuration on the clinical outcome following surgical regenerative therapy of peri-implantitis. J Clin Periodontol 2010;37:449-55.